مزایای الکترولیز نمک
- حجم بسیار کمتر نمک نسب به آب ژاول
- کاهش هزینه حمل مواد اولیه به تصفیه خانه
- كاهش هزينه تامين مواد شيميايي مصرفي
- ایمنی و نداشتن خطرات گاز کلر
- پایداری محلول گندزدا
- محصولات جانبی کم
- آسانی تهیه مواد اولیه
- كاهش زمان تماس و دوز مصرفي گندزدا در طول شبكه
- مقدار pH آب را افزایش نمی دهد

کاربرد الکترولیز نمک
- تصفیه آب آشامیدنی شهرها
- تصفیه آب مجموعه های ورزشی و مجتمع های مسکونی
- تصفیه آب استخر و آبنما
- تصفیه آب فرایندهای صنعتی مثل کولینگ تاور
- تصفیه آب تولیدی های مواد غذایی و نوشیدنی
- گندزدایی و احیای فاضلاب
مواد مصرفی دستگاه الکترولیز نمک طعام
- نمک طعام
- آب
- جریان الکتریسیته
مقدار نمک مصرفی متناسب با حجم آب محاسبه میشود و به رآکتور دستگاه منتقل می شود.
با عبور الکتریسیته در رآکتور، هیپوکلریت سدیم و هیدروژن نهایی از دستگاه خارج و در یک مخزن ذخیره می شود.
NaCl + H2O ———–> NaOCl +H2
مراحل فرآیند الکترولی
- بصورت آنلاین مقدار نمک لازم محاسبه و به راکتور تزریق میشود
- عبور جریان الکتریسیته موجب فرآیند الکترولیز میشود
- آب ژاول بعنوان محصول نهایی در یک مخزن نگهداری می شود
- از آب ژاول برای گندزدایی آب استفاده می شود
مقدمه
با افزایش نیاز صنایع و تأسیسات مختلف به ضدعفونی مطمئن و پایدار آب، استفاده از روشهای سنتی گندزدایی مانند کلر گازی یا هیپوکلریت آماده با چالشهای متعددی از جمله خطرات ایمنی، هزینههای حملونقل و ناپایداری مواد شیمیایی مواجه شده است. در این میان، پکیج الکترولیز نمک طعام که با نام الکتروکلریناتور (Electrochlorinator) نیز شناخته میشود، بهعنوان یک فناوری ایمن، اقتصادی و مدرن، جایگاه ویژهای در سیستمهای تصفیه و ضدعفونی آب پیدا کرده است.
این سیستم با استفاده از نمک طعام (NaCl) و جریان برق، محلول هیپوکلریت سدیم را در محل تولید کرده و برای گندزدایی آب شرب، آب صنعتی، فاضلاب و آب استخرها مورد استفاده قرار میدهد.
الکتروکلریناتور چیست؟
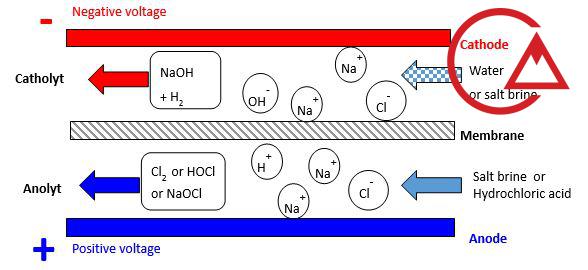
الکتروکلریناتور دستگاهی است که از فرآیند الکترولیز محلول آبنمک برای تولید کلر فعال استفاده میکند. در این فرآیند، یونهای کلرید موجود در نمک طعام تحت تأثیر جریان الکتریکی به ترکیبات ضدعفونیکننده قوی تبدیل میشوند.
محصول نهایی این فرآیند معمولاً هیپوکلریت سدیم با غلظت پایین (۰.۶ تا ۱ درصد) است که بلافاصله و بدون نیاز به ذخیرهسازی طولانیمدت، در سیستم تزریق میشود.
اساس عملکرد پکیج الکترولیز نمک طعام
عملکرد الکتروکلریناتور بر پایه واکنشهای الکتروشیمیایی در یک سلول الکترولیز است:
حل شدن نمک طعام در آب و تولید محلول آبنمک
عبور محلول از داخل سلول الکترولیز
اعمال جریان مستقیم (DC) به الکترودها
آزاد شدن کلر فعال و تشکیل هیپوکلریت سدیم
تزریق محلول تولیدشده به جریان آب هدف
واکنش کلی بهصورت ساده به شکل زیر است:
NaCl + H₂O + Electricity → NaOCl + H₂
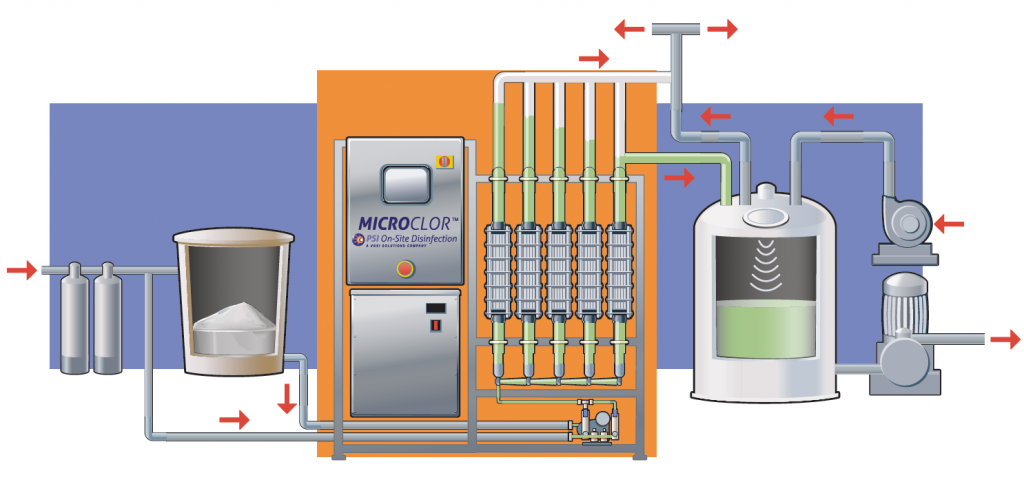
اجزای اصلی پکیج الکتروکلریناتور
یک پکیج الکترولیز نمک طعام معمولاً از اجزای زیر تشکیل میشود:
مخزن تهیه آبنمک (Brine Tank)
سلول الکترولیز با الکترودهای تیتانیومی پوششدار
منبع تغذیه و رکتیفایر (AC به DC)
تابلو برق و سیستم کنترل هوشمند
پمپ تزریق یا سیستم دوزینگ
سیستم ایمنی و سنسورهای کنترلی
طراحی این اجزا بهصورت پکیج، نصب و بهرهبرداری را بسیار ساده میکند.
انواع الکتروکلریناتورها
الکتروکلریناتورها بر اساس نوع کاربرد و ظرفیت به چند دسته تقسیم میشوند:
1. الکتروکلریناتور آب شرب
مناسب برای:
تصفیهخانههای آب شهری و روستایی
ایستگاههای پمپاژ
تأسیسات آبرسانی
2. الکتروکلریناتور صنعتی
مورد استفاده در:
صنایع نفت، گاز و پتروشیمی
نیروگاهها
صنایع غذایی و دارویی
3. الکتروکلریناتور استخر و مراکز تفریحی
برای:
استخرهای شنا
پارکهای آبی
مراکز ورزشی
مزایای استفاده از پکیج الکترولیز نمک
استفاده از الکتروکلریناتور نسبت به روشهای سنتی مزایای متعددی دارد:
✔ ایمنی بسیار بالا
عدم نیاز به کلر گازی خطرناک یا مواد شیمیایی غلیظ
✔ تولید کلر در محل (On-site Generation)
حذف هزینههای حمل، انبارش و ریسک نشت
✔ هزینه بهرهبرداری پایین
نمک طعام مادهای ارزان و در دسترس است
✔ کیفیت پایدار ضدعفونی
تولید تازه هیپوکلریت با راندمان بالا
✔ سازگار با محیط زیست
کاهش ضایعات شیمیایی و انتشار گازهای خطرناک
مقایسه الکتروکلریناتور با روشهای سنتی کلرزنی
| روش | ایمنی | هزینه | پایداری | نگهداری |
|---|---|---|---|---|
| کلر گازی | بسیار پایین | بالا | متوسط | پرخطر |
| هیپوکلریت آماده | متوسط | متوسط | پایین | نیازمند انبار |
| الکتروکلریناتور | بسیار بالا | پایین | بالا | آسان |
کاربردهای پکیج الکترولیز نمک طعام
الکتروکلریناتورها در طیف وسیعی از پروژهها استفاده میشوند:
گندزدایی آب شرب شهری و روستایی
ضدعفونی فاضلاب قبل از تخلیه
سیستمهای خنککاری صنعتی
آب در گردش برجهای خنککننده
صنایع غذایی، لبنی و نوشیدنی
استخرها و جکوزیها
نکات مهم در انتخاب الکتروکلریناتور
برای انتخاب صحیح پکیج الکترولیز نمک باید به موارد زیر توجه کرد:
ظرفیت تولید کلر (گرم در ساعت)
کیفیت و نوع الکترودها
سیستم کنترل و اتوماسیون
مصرف انرژی
خدمات پس از فروش و تأمین قطعات
انتخاب صحیح باعث افزایش طول عمر دستگاه و کاهش هزینههای نگهداری میشود.
نگهداری و بهرهبرداری
نگهداری الکتروکلریناتور نسبتاً ساده است و شامل موارد زیر میشود:
بررسی دورهای الکترودها
شستوشوی سلول در صورت رسوبگیری
کنترل غلظت نمک
بررسی عملکرد تابلو برق
با رعایت این موارد، عمر مفید دستگاه میتواند به بیش از ۱۰ سال برسد.
جمعبندی
پکیج الکترولیز نمک طعام (الکتروکلریناتور) یکی از مدرنترین و ایمنترین روشهای تولید کلر برای ضدعفونی آب در مقیاسهای مختلف است. این سیستم با تکیه بر فناوری تولید در محل، ضمن کاهش هزینهها و ریسکهای ایمنی، کیفیت پایدار و قابل کنترلی از گندزدایی را فراهم میکند.
امروزه استفاده از الکتروکلریناتور نهتنها یک انتخاب فنی، بلکه یک تصمیم هوشمندانه اقتصادی و زیستمحیطی برای صنایع و تأسیسات محسوب میشود.

- سیستم الکترولیز نمک طعام

چه مقدار نمک طعام برای یک تصفیه خانه با ظرفیت 360000 مترمکعب در شبانه روز برای کدورت بالا در حد 30 مورد نیاز است و سیکل آنرا نیز لطفا ترسیم بفرمایید . برای یک تصفیه خانه که دارای پیش ته نشینی اولیه و ثانویه است .
Astonishing course of expression. Keep it up!
روش کلر زنی به علت آنکه عناصر هالوژنه از جمله کلر سمّی و اکسید کننده و خورنده اند منسوخ شده….در کشورهای پیشرفته ی جهان نظیر ایالات متحده آمریکا و کشورهای اروپایی و ژاپن و چین برای گند زدایی آب از گاز اُزن یا تابش اشعه ی گاما استفاده می شود که عوارض جانبی کلر مثل تولید کلرو آلکان های سرطانزا در آب و ریزش مو را ندارد.