ساختار سنسور pH
- الکترود شیشه ای
- بافر داخلی
- الکترود مرجع خارجی
- ولت متر
بافر داخلی یک pH مشخص دارد. یک سیم از بافر به الکترود شیشه ای متصل شده است و جریان الکتریکی ثابت دارد.
با گذشت زمان و از کالیبره خارج شدن سنسور pH در تایم های خیلی کوتاه، ما را مجاب به ریشارژ بافر داخلی و الکترولیت میکند.
کاربرد سنسور pH
با توجه به اینکه مقدار pH میتواند بر سرعت واکنشهای شیمیایی و چگونگی آنها تاثیر بگذارد، اندازه گیری آنلاین و لحظهای آن در صنایع مختلف اهمیت دارد از جمله:
- تصفیه آب
- تصفیه فاضلاب
- داروسازی
- صنایع غذایی
- جلوگیری از خوردگی
سنسور pH پرومیننت جهت اندازه گیری محدوده های مختلف pH در انواع آب مقطر تا آب صنعتی و پساب قابل ارائه است.
دانلود کاتالوگ سنسور های آب
اصطلاح pH
- pH در واقع از کلمه Hydrogene که یک کلمه فرانسوی است گرفته شده
- اصلاح PH مخفف دو کلمه Hydrogene و power است
- نمایشگر قدرت یونی هیدروژن در آب است
- نسبت مولوکولهای یونیزه به غیر یونیزه در محیط آبی است
- بیانگر درصد اسیدی یا قلیایی سیال آب نیز هست

سنسور pH پرومیننت جهت اندازه گیری محدوده های مختلف pH در انواع آب مقطر تا آب صنعتی و پساب قابل ارائه است.
این سنسور با کنترلر بسیاری از انواع برندهای دیگر سازگار است.
سنسور pH در انواع مختلف آماده تحویل فوری است و در تهران موجود است. شرکت مهار فن ابزار معمولا سنسورهای pH با این تایپ ها را برای تحویل سریعتر موجود دارد 1001586 150041
سنسورهای پتانسیومتری
سنسور pH یک سنسور پتانسیومتری است. این سنسورها معمولا از نوع الکترودهای شیشه ای و برای پارامترهای pH, ORP, Floride زیر می باشند. خروجی سیگنال این سنسورها mV بوده و با استفاده از کابل مخصوص شیاردار تا فواصل ۱۰ متری قابل استفاده می باشند.
کالیبراسیون سنسور pH
هنگام راه اندازی سنسور pH کالیبراسیون سنسور یک امر حیاتی است.
بافر کالیبراسیون سنسور pH در مقادیر مختلف قابل تهیه از بازار و فروشندگان مواد شیمیایی است.
- ابتدا الکترود را از محفظه خارج کرده
- الکترود را با آب مقطر میشوییم
- با یک دستمال به نرمی خشک می کنیم
- آن را داخل یک بافر کرده
- صبر میکنیم تا عدد ثابت شود
- آنالایزر را کالیبره می کنیم
- مراحل 2 الی 6 را با بافر دوم تکرار میکنیم

سازندگان سنسور pH
- پرومیننت آلمان
- یوکوگاوا Yokogawa
- متلر تولدو Mettler Toledo
- بلو لب Bluelab
- اندرس هازر آلمان
- سنسورکس امریکا
- آکواسول Aquasol
- نپتون Neptune
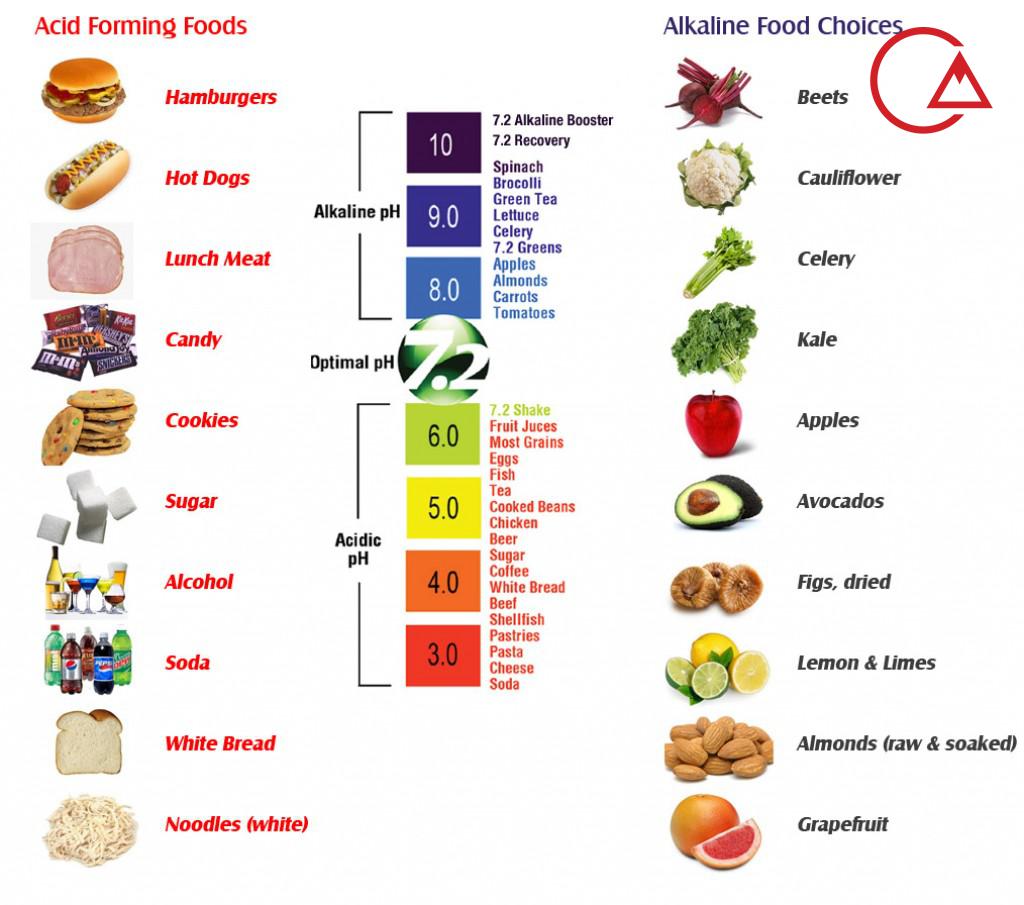
روش های اندازه گیری PH
- روش رنگی که در مدارس با کاغذ تورنسل انجام می دادیم
- روش الکتریکی که از یک پراب جهت این کار استفاده میکند و روش آنلاین بحساب می آید
عملکرد PH متر الکتریکی
- یک مدار الکتریکی به خوانش مقدار pH کمک میکند
- یک الکترود شیشه ای و یک الکترود در محلول مرجع و یک ولت متر استفاده میشود
- ولت متر اختلاف ولتاژ این دو الکترود را اندازه گیری میکند
کالیبراسیون سنسور pH
- هنگاه راه اندازی سنسور pH لازم است آن را کالیبره کنیم
- برای این کار از محلول بافر با pH مشخص استفاده میکنیم
- لازم است بافری نزدیک به pH آب مورد آزمایش انتخاب کنیم
- ابتدا سیستم را روشن میکنیم
- الکترود را با آب مقطر می شوییم
- با یک دستمال بدون پرز به نرمی خشک میکنیم
- یا با تکان دادن آرام سعی در خشک شدنش میکنیم
- پراب را در بافر فرو میبریم
- حدود یک دقیقه صبر میکنیم تا عدد تقریبا ثابت شود
- حالا عدد pH را روی pH بافر تنظیم میکنیم
- این کار بهتر است با دو بافر انجام شود تا دقت بالا برود
کالیبراسیون سنسور pH
در صورتی که محدوده اندازهگیری pH بالاتر از 7 باشد میبایستی سنسور و پردازشگر را در بافرهای 7 و 10 کالیبره کنیم و اگر محدوده اندازهگیری pH پایینتر از 7 باشد سنسور و پردازشگر را در بافرهای 4 و 7 کالیبره میکنیم.
لازم به ذکر میباشد پردازشگرهای pH ارائه شده کمپانی ProMinent دارای منوی کالیبراسیون دو نقطهای میباشد و حتماً میبایستی در دو نمونه بافر کالیبره شوند.
نحوه کالیبراسیون:
- ابتدا سنسور را از محفظه سنسور که از KcL 3 molar پر شده است خارج کرده
- سپس سنسور را با کمی آب مقطر شستشو داده
- سپس با دستمال بدون پرز آن را خشک کرده
- وارد منوی کالیبراسیون پردازشگر pH شده و اقدامات اشاره شده در ذیل را جهت کالیبراسیون سنسور و پردازشگر انجام دهید
- ابتدا سنسور را وارد بافر pH 10 کرده و سنسور را کالیبره کرده (حداکثر زمان انتظار 30 ثانیه)
- سنسور را شستشو داده و وارد pH 7 کرده و مجدد سنسور را کالیبره میکنیم.
نگهداری سنسور pH
- سنسور pH هر یک ماه یکبار بایستی از نظر شکستگی و رسوب بررسی شود و در صورت نیاز تعویض و یا شستشو داده شود.
- در صورت مشاهده رسوب بر روی محفظه شیشهای سنسور pH متناسب با نوع رسوب از حلالهای شیمیایی ذیل استفاده نمایید.
بعد از تمیز کردن سنسورها توسط حلالهای مربوطه میبایستی سنسور را با آب شستشو داد
- سنسور pH حتماً باید در محفظه KcL 3 molar نگهداری شود
- بررسی کنید که در قسمت داخلی سنسورهای شیشهای حباب هوا وجود نداشته باشد و در صورت وجود حباب هوا، سنسور را در جهت پایین نگه داشته و سنسور را برای مدت کوتاهی تکان میدهیم.
طول عمر سنسورهای pH متناسب با نوع آب بین 6 ماه تا 3 سال پس از تاریخ تولید میباشند.
محلول کاهش PH آب
- تنظیم کننده اسیدیته آب اهمیت ویژه ای دارد
- که میزان مصرف آن بستگی به اسیدیته (PH) و سختی آب مورد استفاده درمحلول پاشی دارد
- به طوری که هرچه آب قلیایی تر و سختی آن بالاتر باشد میزان مصرف این محلول بیشترمی شود
- پس از اضافه کردن این محصول به آب محلول پاشی، آب رنگی شده و به مرور و با افزایش میزان فرآورده، رنگ آب تغییر می کند
- که به راحتی می توان با مقایسه رنگ آب با طیف رنگی روی برچسب محلول ، اسیدیته آب را تنظیم کرد.
- همچنین این محصول علاوه بر تنظیم کننده اسیدیته آب به علت داشتن آنتی فوم از ایجاد کف در مخزن محلول پاشی جلوگیری می کند.
ویژگی های محلول تنظیم pH
- اصلاح کننده آب مصرفی محلولپاشی از طریق تنظیم اسیدیته (PH) آب
- حذف املاح معلق در آب
- افزایش توان کلر آزاد
نحوه عملکرد دستگاه pH متر مدل Dulcometer D1C
در حالت کلی دستگاه pH متر مدل Dulcometer D1C دارای کانالهای ورودی و خروجی به شرح زیر میباشد:
ورودیها:
- ورودی سنسور pH
- ورودی سنسور تصحیح دما
- ورودی حالت مکث (Pause)
- ورودی سنسور جریان سیال
- ورودی منبع تغذیه
خروجیها:
- دو خروجی 4-20 mA قابل برنامهریزی متناسب با تغییرات pH
- دو خروجی پالس متناسب با تغییرات pH (PID control)
- خروجی رله برای مقادیر حدی یا شیرهای سولنوئیدی یا آلارم
سنسور pH
سنسورهای pH از دسته سنسورهای پتانسیومتری با خروجی mV میباشند.
برای انتقال سیگنال سنسور به پردازشگر D1C نیاز به کابل شیلددار مخصوص حداکثر به طول 10 متر میباشد.
شرکت ProMinent به منظور رفع این محدودیت فاصله و همچنین کاهش احتمال ایجاد پارازیت در سیگنال mV قطعه الکترونیکی به عنوان Transducer طراحی کرده که خروجی mV سنسور را به خروجی 4-20 mA تبدیل میکند.
در این حالت امکان ارسال سیگنال سنسور به پردازشگر توسط دو رشته سیم معمولی تا فواصل حدود 100 متر میسر میگردد.
نمایش مقدار pH
صفحه نمایش دستگاه Dulcometer D1Cامکان نمایش عدد pH و همچنین میزان دمای نمونه مورد آنالیز (به شرطی که سنسور دمای pt 100 در مجموعه آنالیزور باشد) را میسر میسازد.
ارسال فرمانهای کنترل به دستگاههای دیگر از جمله پمپهای دوزینگ اسید و قلیا
با توجه به تنوع خروجیهای دستگاه Dulcometer D1C هر پمپ دوزینگ یا دستگاه دیگر که دارای ورودی سیگنال پالس یا 4-20 mA باشد میتواند توسط این پردازشگر کنترل شود. به این معنی که ظرفیت پمپ دوزینگ به مقدار مورد نیاز از طریقDulcometer D1C تنظیم میشود.
انواع مختلف پمپهای دوزینگ ProMinent قابلیت کار با یکی از روشهای فوق را دارند بنابراین کنترل pH یک نقطه به راحتی توسط یک دستگاه آنالیزور pH و یک یا دو پمپ دوزینگ امکانپذیر است.
در این روش با توجه به قابلیت فرمانپذیر پمپ، منبع تغذیه متناسب با مدل پمپ به آن متصل بوده و فرمان Start-pause و یا تغییر ظرفیت از طریق دستگاه پردازشگر از طریق سیگنالهای اشاره شده در فوق به پمپ ارسال میگردد.
فواید
- سنسورهای pH و فرستنده های ما از تمام قابلیت های اصلی تا اندازه گیری چند کاناله و چند پارامتر برخوردار هستند.
- ما بافر pH، pH محلول و استاندارد pH برای کالیبراسیون pH به دقت نهایی ارائه می دهیم. آنها در آزمایشگاه کالیبراسیون دائمی خود که با موفقیت اعتباربخشی DAkkS (مقام صدور مجوز آلمان) را به تصویب رساندند، تولید می شوند.
- انواع مختلف الکترود ها انواع دیافراگم ها و سیستم های مرجع را پوشش می دهد، از اتصالات PTFE ضد گلوله بر روی دیافراگم های بسیار سرامیکی مقاوم در برابر سوراخ های مقاوم در برابر مسدود.
- ما مجموعه های PH برای همه زمینه های کاربردی ارائه می دهیم: مجموعه های ثابت نصب، مجموعه های غوطه وری، مجتمع های جریان و مجموعه های جمع آوری شده.
- سیستم های خودکار برای کالیبراسیون، تنظیم و تمیز کردن عملکردهای مطلوب سنسورهای pH و فرستنده ها را در فرایندهای شیمیایی، تولید داروها و یا کاربرد های بهداشتی اطمینان می دهند.
درباره pH سنسورها
- سنسورهای pH علمی Campbell اندازه گیری سطح pH در محلول های نمونه با اندازه گیری فعالیت یون های هیدروژنی در محلول ها می باشد. این فعالیت با آب خالص (راه حل بی طرف) با استفاده از یک مقیاس pH از 0 تا 14 برای تعیین اسیدیته یا قلیایی محلول های نمونه مقایسه می شود.
آزمایشگاه pH سنسورها، پروب ها و الکترودها
- سنسورهای pH: برای طیف وسیعی از برنامه ها و بخش ها (مانند داروسازی، بیوتکنولوژی، لوازم آرایشی، مواد غذایی و آشامیدنی، مواد شیمیایی، آزمایشگاه های آزمایشگاهی، آموزش) برای آزمایشگاه و استفاده از زمینه.
pH سنسورها، پروب ها و الکترودها
- pH قابل تجدید پذیر پروب ها و پروتئین های Redox پروتئین های بهداشتی pH برای پروتئین های استریل پروتئین pH مناسب برای برنامه های کاربردی سخت استفاده از آب خالص برنامه های کاربردی آب خالص نرم افزار های غیر حساس (ISFET)
آزمایشگاه pH سنسورها، پروب ها و الکترودها
- سنسورهای pH: برای طیف وسیعی از برنامه ها و بخش ها (مانند داروسازی، بیوتکنولوژی، لوازم آرایشی، مواد غذایی و آشامیدنی، مواد شیمیایی، آزمایشگاه های آزمایشگاهی، آموزش) برای آزمایشگاه و استفاده از زمینه.
pH سنسورها، پروب ها و الکترودها
- pH قابل تجدید پذیر پروب ها و پروتئین های Redox پروتئین های بهداشتی pH برای پروتئین های استریل پروتئین pH مناسب برای برنامه های کاربردی سخت استفاده از آب خالص برنامه های کاربردی آب خالص نرم افزار های غیر حساس (ISFET)
همه چیز در مورد اسید ها
تعریف قدیمی اسیدها
اسیدها موادی ترش مزه اند خاصیت خورندگی دارند شناساگرها را تغییر رنگ می دهند و بازها را خنثی می کنند.
بازها موادی با طعم گس-تلخ اند حالتی لزج دارند شناساگرها را تغییر رنگ می دهند و اسیدها را خنثی می کنند.
لی بیگ
اسیدها موادی هستند که در ساختار خود هیدروژن یا هیدروژنهایی دارند که در واکنش با فلزها توسط یون های فلز جایگزین می شوند.
آرنیوس
- اسیدها موادی هستند که ضمن حل شدن در آب یون +H آزاد می کنند. بازها موادی هستند که ضمن حل شدن در آب یون -OH آزاد میکنند.
- این تعریف فقط به موادی محدود میشود که در آب قابل حل باشند.
- حدود سال ۱۸۰۰، شیمی دانان فرانسوی از جمله آنتوان لاووازیه، تصور می کرد که تمام اسیدها دارای اکسیژن هستند.
- شیمی دانان انگلیسی از جمله سر همفری دیوی، معتقد بود که تمام اسیدها دارای هیدروژن هستند.
- شیمی دان سوئدی، سوانت آرنیوس، از این عقیده برای گسترش تعریف اسید استفاده نمود.
لوری-برونستد
- اسیدگونهای است که در واکنش شیمیایی پروتون (یون+H)می دهد و باز گونه ای است که در واکنش شیمیایی پروتون (یون+H) می پذیرد.
- لوری و برونستد این تعریف را بیان کردند،
- که از آن بر خلاف تعریف آرنیوس میتوان در محیط غیر آبی هم استفاده کرد.
لوییس
- اسیدها موادی هستند که در واکنش های شیمیایی پیوند داتیو می پذیرند.
- بازها موادی هستند که در واکنش های شیمیایی پیوند داتیو می دهند.
- تعریف لوییس را با نظریه اوربیتال مولکولی هم میتوان بیان کرد.
- به طور کلی، اسید میتواند یک جفت الکترون از بالاترین اوربیتال خالی در پایین اوربیتال خالی خود دریافت کند.
- این نظر را گیلبرت ن. لوییس مطرح کرد.
- با وجود این که این تعریف گستردهترین تعریف است،
- تعریف لوری-برونستد کاربرد بیشتری دارد. با استفاده از این تعریف میتوان میزان قدرت یک اسید را هم مشخص نمود.
- از این مفهوم در شیمی آلی هم استفاده میشود (مثلاً در کربوکسیلیک اسید).
نگاه اجمالی
- بشر از دیر باز با مفهوم ساده اسید آشنایی داشته است.
- در حقیقت این مواد، حتی قبل از آنکه شیمی به صورت یک علم در آید، شناخته شده بودند.
- اسیدهای آلی همچون سرکه و آبلیمو و آب غوره از قدیم معروف بودند.
- اسیدهای معمولی مانند اسیدسولفوریک ،اسیدکلریدریک و اسیدنیتریک بوسیله کیمیاگران قدیم ساخته شدند و بصورت محلول در آب بکار رفتند.
- برای مثال اسید سولفوریک را جابربن حیان برای نخستین بار از تقطیر بلورهای زاج سبز (FeSO۴.۷H۲O) و حل کردن بخارات حاصل در آب ، بدست آورد.
در طی سالیان متمادی بر اساس تجربیات عملی لاووازیه (A.L.Lavoisier) چنین تلقی میگردید که اجزاء ساختمان عمومی کلیه اسیدها از عنصر اکسیژن تشکیل گردیده است. اما به تدریج این موضوع از نظر علمی روشن و اعلام گردید که چنانچه این موضوع صحت داشته باشد، بر خلاف عقیده اعلام شده در مورد اکسیژن، این عنصر هیدروژن است. در حقیقت، تعریف یک اسید بنا به فرمول اعلام شده از سوی لیبیگ (J. Von Liebig) در سال ۱۸۴۰ عبارت است از:
ـ موادی حاوی هیدروژن که میتوانند با فلزات واکنش نموده و گاز هیدروژن تولید نمایند.
ـ نظریه فوق مدت پنجاه سال مورد استناد بوده است. بعدها با پیشرفت علم شیمی ، مفاهیم جدیدی درباره اسیدها اعلام شده که در زیر به بررسی آنها خواهیم پرداخت.
خواص عمومی اسیدها
- محلول آبی آنها یونهای پروتون آزاد میکند.
- موادی هستند که از نظر مزه ترشند.
- کاغذ تورنسل را سرخ رنگ میکنند.
- با برخی فلزات مانند آهن و روی ترکیب شده گاز هیدروژن میدهند.
- با قلیاها (بازها) واکنش نموده و املاح را تشکیل میدهند.
- با کربنات کلسیم (مثلا به صورت سنگ مرمر) بشدت واکنش دارند
- به طوری که کف میکنند و گاز کربنیک آزاد مینمایند.
نظریه آرنیوس درباره اسیدها
زمانیکه مفاهیم یونیزاسیون ترکیبات شیمیایی در محلولهای آبی روشن گردید، مفهوم اسید بطور قابل ملاحظهای تغییر پیدا کرد. مطابق تعریف آرنیوس ، اسید ماده ایست که در آب یونیزه میشود و یون +H۳O که گاهی بصورت +H نیز نشان داده میشود، تولید میکند.
(HCl —–> H+ + Cl-(aq
آرنیوس قدرت اسیدی را نیز بر همین اساس تفسیر کرد و گفت که اسید قوی ، در محلولهای آبی تقریباً، بطور کامل یونیزه میشود. در صورتی که که میزان تفکیک اسید ضعیف کمتر است. توجه کنید که مفهوم آرنیوس بر یونهای آب استوار است. بر اساس تعریف آرنیوس میتوان نقش اکسیدهای اسیدی را نیز تفسیر کرد.
اکسیدهای اسیدی
اکسیدهای بسیاری از غیر فلزات با آب واکنش داده و اسید تولید میکنند، در نتیجه این مواد را اکسیدهای اسیدی یا ایندرید اسید مینامند.
N۲O۵(s) + H۲O → H+ + NO۳-aq
مفهوم آرنیوس، به علت تاکید آن بر آب و واکنشهای محلولهای آبی، با محدودیت روبهروست.
اسید ۲ + باز ۱ <—– اسید ۱ + باز ۲
قدرت اسیدها ، بر میل آنها برای از دست دادن یا گرفتن پروتون استوار است. هر چه اسید قویتر باشد، باز مزدوج آن ضعیفتر است. در یک واکنش ، تعادل در جهت تشکیل اسید ضعیفتر است. اسید پرکلریک، HClO۴، قویترین اسید است و باز مزدوج آن ، یعنی یون پرکلرات، -ClO۴ ، ضعیفترین باز میباشد و H۲، ضعیفترین اسید و باز مزدوج آن یعنی یون هیدرید، +H قویترین باز میباشد.
نظریه لوییس درباره اسیدها
گیلبرت لوییس مفهوم گستردهتری برای اسیدها در سال ۱۹۳۸ پیشنهاد داد که پدیده اسید – باز را از پروتون رها ساخت. طبق تعریف لوییس ، اسید مادهای است که بتواند با پذیرش یک زوج الکترون از باز ، یک پیوند کوولانسی تشکیل دهد. در نظریه لوییس به مفهوم زوج الکترون و تشکیل پیوند کووالانسی تاکید میشود. تعریف لوییس در مورد اسیدها بسیار گستردهتر از آن است که برونشتد عنوان نموده است. ترکیبات شیمیایی که میتوانند نقش اسید لوییس داشته باشند، عبارتند از :
مولکولها یا اتمهایی که هشتتایی ناقص داشته باشند.
(BH۳ + F- → BH۴-(aq
بسیاری از کاتیونهای ساده میتوانند نقش اسید لوییس داشته باشند.
Cu+۲ + ۴NH۳ → Cu(NH۳)۴+۲
برخی از اتمهای فلزی در تشکیل ترکیباتی مانند کربونیلها که از واکنش فلز با مونوکسید کربن تولید میشود، نقش اسید دارند:
Ni + ۴CO → Ni(CO)۴
ترکیباتی که اتم مرکزی آنها توانایی گسترش لایه ظرفیتی خود را داشته باشند ، در واکنشهایی که این گسترش عملی شود، نقش اسید دارند، مثلا در واکنش مقابل ، لایه ظرفیتی اتم مرکزی (Sn) از ۸ به ۲ الکترون گسترش یافتهاست.
SnCl۴ + ۲Cl- → SnCl۶-۲aq
برخی ترکیبات به علت داشتن یک یا چند پیوند دوگانه در مولکول، خاصیت اسیدی دارند. مثلا CO۲
قدرت اسیدی و ساختار مولکولی به منظور بررسی رابطه بین ساختار مولکولی و قدرت اسیدی، اسیدها را به دو نوع تقسیم میکنیم: هیدریدهای کووالانسی و اکسی اسیدها.
هیدریدها
برخی از ترکیبات کووالانسی دوتایی هیدروژندار (مانند HCl , H۲) اسیدی هستند. دو عامل بر قدرت اسیدی هیدریدیک عنصر مؤثر است: الکترونگاتیوی عنصر و اندازه اتمی عنصر. قدرت اسیدی هیدریدهای عناصر یک تناوب ، از چپ به راست و همسو با الکترونگاتیوی عناصر، افزایش مییابد. یک عنصر الکترونگاتیو، الکترونهای بیشتری از هیدروژن میگیرد و خروج آن به صورت یک پروتون را سرعت میبخشد.
قدرت اسیدی هیدریدهای عناصر یک گروه، با افزایش اندازه اتم مرکزی افزایش مییابد. در تناوب دوم: NH۳>H۲O>HF در گروه VI به این صورت است:
H۲Te > H۲Se > H۲S > H۲O
اکسی اسیدها
در این ترکیبات ، هیدروژن اسیدی به یک اتم O متصل است و تغییر در اندازه این اتم بسیار ناچیز است. بنابراین عامل کلیدی در قدرت اسیدی این اکسیاسیدها، به الکترونگاتیوی اتم Z مربوط میشود:
H-O-Z .
اگر Z یک اتم غیرفلز با الکترونگاتیوی بالا باشد، سهمی در کاهش چگالی الکترونی پیرامون اتم O (علی رغم الکترونگاتیوی شدید اکسیژن) را دارد. این پدیده باعث میشود که اتم اکسیژن، با کشیدن چگالی الکترونی پیوند H-O از اتم H ، تفکیک آن را سرعت ببخشد و ترکیب را اسیدی بکند. هیپوکلرواسید ، HOCl ، اسیدی از این نوع است.
هرچه الکترونگاتیوی Z بیشتر باشد، الکترونهای پیوند H-O به میزان بیشتری از اتم H دور میشوند و حذف پروتون آسانتر است:
HOCl > HOBr > HOI . در اکسی اسیدهایی که اتمهای اکسیژن بیشتری به Z متصل باشند، قدرت اسیدی با افزایش n ، زیاد میشود.
مهمترین اسیدهای قوی
مولکولهای این اسیدها و در محلولهای آبی رقیق کاملاً یونیزه است. اسیدهای قوی متعارف عبارتند از: اسید کلریدریک، یدیدریک، نیتریک، سولفوریک، پرکلریک است.
مهمترین اسیدهای ضعیف
- یونیزاسیون این اسیدها در آب کامل نمیباشد و هرگز به ۱۰۰% نمیرسد.
- مثال متعارف آنها، اسید استیک، اسید کربنیک، اسیدفلوریدریک، اسید نیترو و تا حدودی اسید فسفریک است.
- اسیدها مزه ترشی دارند بعضی اسیدها سمی هستند بعضی باعث سوختگی های شدید می شوند
- و تعدادی نیز کاملاً بی ضرر به شمار می آیند بعضی اسیدها نیز خوراکی و بسیار مفید هستند ما اسید سیتریک را از پرتقال و لیموترش به دست می آوریم بدنمان هم اسیدهایی را می سازند که به گوارش غذا کمک می کنند.
- اسید سولفوریک یکی از قوی ترین و مهم ترین اسیدها است که به مقدار فراوان در تولید انواع کود ، فرآورده های نفتی و آهن و فولاد بکار گرفته می شوند
آب باتری اتومبیل ها
- اسید سولفوریک رقیق شده با آب خالص است سایر اسیدهای قوی عبارتند از: اسید نیتریک و اسید کلریدریک.
- بازها یا قلیاها موادی هستند که مخالف و ضد اسیدها به شمار می آیند گرچه بعضی بازها از قبیل آهک (هیدروکسید کلسیم) و سود سوز آور همانند اسیدها خیلی فعال و خورنده هستند
- از بازها در فرآیند های صنعتی استفاده می شوند هیدروکسید منیزیم (مایع یا پودر سفیدی که برای برطرف کردن درد ناشی از حالت اسیدی معده مصرف می کنیم) نمونه ای از یک باز ملایم است بازی که در آن قابل حل می باشد،
- قلیا نامیده می شود وقتی یک اسید و یک باز به نسبت مناسب با هم مخلوط می شوند یکدیگر را خنثی می کنند
- برای مثال اگر اسید کلریدریک با سود سوز آور مخلوط شود حاصل واکنش آنها نمک معمولی و آب خواهد بود بعضی مواد وقتی با اسید و بازها تماس پیدا می کنند
- تغییر رنگ می دهند این مواد را معرف یا شناساگر می نامند تعنسل در محلول اسیدی از آبی به قرمز تغییر رنگ می دهند و در محلولهای قلیایی از قرمز به آبی می گراید .
اسید سولفوریک
- اسید سولفوریک احتمالاً مهمترین ترکیب شیمیایی موجود است و دهها مورد استفاده دارد که از تولید کود و پارچه تا ساخت دارو و مواد منفجره را شامل می شود این اسید در انباره که نوعی باطری است
- معمولاً در موتور اتومبیل مورد استفاده قرار می گیرد نیز وجود دارد اسید سولفوریک را به روش تماسی تقلید می کنند کانه هوایی که محتوی سولفید های فلزی یا گوگرد هستند در هوا سرخ یا برشته می شوند
- تا دی اکسید گوگرد به دست می آید سپس این گاز را در مجاورت یک کاتالیزور (یکی از اسید های فلز و وانادیم) حرارت می دهند
- تا آن را به واکنش بیشتر با هوا وارد و تری اکسید گوگرد حاصل شود در مرحله بعد تری اکسید را در اسید سولفوریک غلیظ حل می کنند
- تا اسیدی به نام اولنوم به دست آید. که سپس به دهقا با افزودن آب رقیق می شود
- و مقدار زیادی اسید سولفوریک برجای می ماند نمکهای اسید سولفوریک را سولفات می نامند
- که ترکیبات بسیار مفیدی را شامل می شوند و در صنایع مختلف از قبیل کود سازی داروسازی رنگ سازی مورد استفاده قرار می گیرند
- اسید سولفوریک ، بیش از هر نوع اسید دیگری در جهان تولید می شود
- و کاربرد دارد اسید سولفوریک را با فرمول شیمیایی HSO نشان می دهند میل شیمیایی شدیدی به آب (HO) دارد
- این خاصیت باعث می شود که اسید سولفوریک بتواند هیدروژن و اکسیژن را از بسیاری از مواد از جمله پوست جذب کند
به همین دلیل
- کار کردن با آن خطرناک و نیاز به مراقبت دارد اسید کلرید مایع بی رنگ و بسیار خطرناک است که در مجاورت هوا دود می کند
- بوی تحریک کننده ای دارد
- بسیار خورنده است
- باعث سوختگیهای شدید می شود
- این اسید را با حل کردن گاز کلرید هیدروژن در آب به دست می آید اسید کلریدریک غلیظ حاوی سه قسمت کلر، ید ، هیدروژن و هفت قسمت آب است کلرید هیدروژن از ترکیب گازهای کلر و هیدروژن به دست می آید
- راه دیگر تولید این گاز ترکیب کلر ید سدیم نمک معمولی با اسید سولفوریک است اسید کلریک یا بازها واکنش می کند و نمکهایی به نام کلرید را به وجود می آورد
- و در صنایع این اسید را برای تولید مواد شیمیایی دیگر یا آماده سازی بعضی از غذاها به کار می گیرند معده انسان نیز اسید کلریدریک ضعیف تولید می کند
- یا طی عمل گوارش به شکسته شدن غذاها کمک می کند
- اسید لاکتیک مایع بی رنگ یا زرد رنگ است که معمولاً در شیر ترشیده و سایر محصولات لبنی ترش شده یا بریده شده دیده می شود
- که اسیددر سرکه نیز وجود دارد و حاصل تخمینه قند است روش تجاری اسید لاکتیک را از تخمینه به دست می آورند
- و در دباغی و پارچه بافی و همچنین برای طعام بعضی غذاهای آماده مورد استفاده قرار می دهند
اسید لاکتیک
- معمولاً در خون انسان و سایر جانوران وجود دارد به طور معمول وقتی ماهیچههای ما به انرژی نیاز دارند این انرژی در اثر شکسته شدن کربو هیدرات به وسیله اکسیژن تولید می شود
- اما وقتی به تمرین ها و ورزش های سخت می پردازیم خون نمی تواند اکسیژن لازم را برای این عمل به بافت های ماهیچه ای برساند
- و در نتیجه کربو هیدرات به شکل بی هوازی بدون اکسیژن شکسته می شوند و اسیدلاکتیک به وجود می آید
- این اسیدمی تواند درد خاصی را در ماهیچه ایجاد کند که درد ناگهانی نامیده می شود
- هنگام ورزشهای آرام ، کلوکز موجود در ماهیچهها به مصرف می رسد تا انرژی تولید شود این فرآیند با تولید دی اکسید کربن و آب همراه است
- در ورزشهای سخت ممکن است اکسیژن لازم برای شکسته شدن کلوکز تأمین نشود در این حالت کلوکز و اسید لاکتیک تبدیل می شود
- وقتی میزان اکسیژن در خون بالا می رود اسید لاکتیک دوباره به گلیکوژن به کلوگز تبدیل می شود
اسیدنیتریک
- مایعی دود کننده بی رنگ و بسیار خورنده است
- مایع خورنده می تواند با مواد واکنش انجام دهد و باعث خوردگی آنها شود اسید نیتریک از ترکیب شدند هیدروژن ، نیتروژن و اکسیژن به وجود می آید و برای تولید کودها مواد منفجره (نظیر نیتر و گلیسیرین ) مورد استفاده قرار می گیرد.
- اسید نیتریک از قرنها پیش شناسایی شده است
- در آغاز قرن بیستم این اسید را از حرارت دادن اسید سولفوریک و نیترات سدیم به دست آوردند
- نیترات سیدم ماده ای طبیعی است که در آمریکای جنوبی یافت می شود وقتی جنگ جهانی دوم آغاز شد مقدار زیادی اسید نیتریک برای تولید مواد منفجره لازم بود
- با تمام شدن ذخایر نیترات سدیم در آلمان یک شیمیدان آلمانی به نام (فریتزهابر) روشی برای تولید اسیدنیتریک با استفاده از آمونیاک و هوا ابلاغ کرد
- در این روش هیدروژن و نیتروژن آمونیاک و اکسیژن هوا بادها ترکیب می شوند و اسید نیتریک را به وجود می آورند
فسفریک اسید
- فسفریک اسید از جمله پرمصرفترین مواد شیمیایی در صنعت است.
- به عنوان ماده افزودنی در نوشابه های گازدار کاربرد دارد
- و در تولید کودهای شیمیایی، پاک کننده های صابونی و غیر صابونی،تصفیه آب،خوراک دام و دارو سازی به کار می رود.
- فسفریک اسید خوراکی را از افزودن آب به P۴O۱۰ می سازند.
کاربرد در صنایع غذایی
- از اسیدفسفریک در تولید غذاهای اسیدی و نوشابه های گازدار مانند انواع کولاها استفاده میشود.
- به کارگیری این ماده سبب دادن طعم تندی به غذا شده، و از آنجا که ماده شیمیایی با تولید انبوه است،
- با قیمتی ارزان و حجمی فراوان در دسترس میباشد.
- همانطور که ذکر شد، قیمت پایین و حجم زیاد تولید این ماده، آنرا در مقایسه با طعم دهنده های طبیعی نظیر زنجبیل برای دادن طعم تندی، یا اسید سیتریک که از لیمو (lemon) و عصاره لیموترش (lime) که برای دادن طعم ترشی بکار میرود، در رتبه بالاتری قرار داده است.
کاربرد در زدودن زنگ آهن
- از اسید فسفریک میتوان مستقیماً برای زدودن زنگ آهن (اکسید آهن III) از ابزارهای آهنی یا فولادی و تبدیل آهن به فسفاتهای محلول در آب استفاده نمود.
- پس از زدودن زنگ آهن فسفات آهن تولید شده تبدیل به ترکیب فسفات آهن سیاه شده که خود به عنوان عامل جلوگیری از خوردگی میتواند مورد استفاده قرار گیرد.
کاربردهای پزشکی
- از اسید فسفریک در دندانپزشکی و اورتودنسی به عنوان عامل قلم زنی (Etching) جهت تمیز کردن و زبر کردن سطح دندان خصوصاً در جاهایی که از اسباب و وسایل دندانپزشکی استفاده شده، بکار میرود.
- همچنین از اسید فسفریک به عنوان کاتالیست در ساخت آسپیرین به خاطر داشتن یون هیدروژن فراوان و آللایندگی کمتر در مقایسه با اسید کلریدریک و سولفوریک استفاده میشود
اسید استیک
- اسید استیک یا جوهر انگور جز اسیدهای کربوکسیلیک است و در نامگذاری آیوپاک به اسید اتانوئیک معروف است.
- نگاه کلی اسید استیک جز اسیدهای کربوکسیلیک میباشد و در نامگذاری آیوپاک به اسید اتانوئیک معروف است. این اسید دارای فرمول شیمیایی میباشد و در قسمت چشایی طعم ترشی ، شبیه طعم سرکه میدهد.
- باکتریهای مخمر سرکه به دلیل تمایل به تولید اسید استیک به این نام معروف شدهاند.
- این باکتریها در مواد غذایی ، آب و خاک یافت میشوند. اسید استیک بطور طبیعی از میوهها و برخی مواد غذایی فاسد شده از فرایند تخمیر تولید میشوند
- و از قدیمیترین ترکیبات شیمیایی شناخته شده توسط انسان میباشد.
- تاریخچه سرکه (اسید استیک رقیق) از دوران باستان برای انسان شناخته شده بود.
- احتمالاً انسانها در دوران باستان هنگام تهیه شراب از فرایند تخمیر به وجود سرکه پی برده بودند.
- فیلسوف یونانی تئوفاراستوس در سه قرن پیش از میلاد چگونگی واکنش سرکه با فلزات و تولید رنگدانه برای استفاده در نقاشی از کربنات سرب و زاجهای سبز ایجاد شده از نمکهای مس و استات مس را توضیح داده است.
- رومیان باستان با نگهداری شراب ترش در قدحهای سربی، شراب بسیار شیرینی به نام Sapa تولید میکردند که طعم شیرین آن ناشی از استات سرب بوده است
- که امروزه دانشمندان مرگ زودرس بسیاری از اشراف روم را به مسمومیت ناشی از این ماده نسبت داده اند.
شیمیدانهای عصر رنسانس
- اسید استیک گلاسیال (منجمد) را از تقطیر خشک استاتهای فلزی تهیه میکردند.
- در سال ۱۸۴۷ هرمن کولب شیمیدان آلمانی برای اولین بار اسید استیک را از مواد معدنی سنتز کرد. خواص اسید استیک خالص ، مایعی بیرنگ با بویی تیز ، مایعی خورنده و قابل اشتعال میباشد.
- این اسید در ۱۶.۶ درجه سانتیگراد منجمد میشود.
- به این دلیل و همچنین ظاهر یخ مانند آن به نام اسید استیک گلاسیال معروف است.
- اسید استیک در محلولهای آبی میتواند تفکیک شده و یون استات تولید کند.
- PH آن برابر با ۴.۸ میباشد، یعنی در PH=۴.۸ نیمی از مولکولهای اسید استیک در محلول آبی به صورت یون استات هستند.
- اسید استیک در حالت بخار شامل دیمرهایی از دو مولکول اسید استیک میباشد که با پیوند هیدروژنی با یکدیگر ارتباط دارند.
- بنابراین اسید استیک در حالت گازی از قانون گازهای ایده آل تبعیت نمیکند. خواص عمومی اسید استیک مانند سایر اسیدهای کربوکسیلیک میباشد.
اسید استیک با الکلها و آمینها واکنش داده
- و به ترتیب تولید استرو آمید میکند. همچنین در اثر واکنش با آلکنها تولید استر استات میکند.
- این اسید در اثر حرارت تا دماهای بالاتر از ۴۴۰Cْ تجزیه شده و تولید و متان میکند.
- تولید سرکه از فرایند تخمیر مواد غذایی دارای نشاسته و قند و مواد الکلی توسط باکتری مخمر سرکه (بچه سرکه) تولید میشود.
- برای تولید سرکه عموما از میوههایی مانند سیب، انگور، دانههایی مثل جو و گاهی هم از شراب استفاده میشود.
- سرکه معمولا دارای اسید استیک با وزن حجمی ۴ الی ۸ درصد میباشد.
- روشهای تولید صنعتی اسید اسیتیک کربونیلاسیون متانول : در این روش متانول با مونوکسید کربن در فشارهای بالا (۲۰۰atm) واکنش داده و اسید استیک تولید میکند.
- این روش از سال ۱۹۲۰ ابداع شده است و به دلیل ارزان بودن متانول و از لحاظ اقتصادی مقرون به صرفه است.
- اکسیداسیون بوتان : از حرارت دادن بوتان با اکسیژن هوا در حضور یونهای فلزی منگنز ، کبالت و کروم ، پروکسید تولید میشود.
- پروکسید در اثر تجزیه اسید استیک ایجاد میکند. { TEX()} {۲C_۴HiO + CO_۲ → ۴CH_۳COOH + ۲H_۲O} {TEX}
اکسیداسیون استالدئید
- استالدئید در شرایط ملایم و در حضور کاتالیزورهای ساده فلزی مثل منگنز و کروم و… توسط اکسیژن هوا اکسید شده و اسید استیک تولید میکند. { TEX()} {۲CH_۳CHO + ۲O_۲ → ۲CH_۳COOH} {TEX}
- محصولات جانبی تولید شده در این واکنش مانند اسید فرمیک یا استات اتیل و… به دلیل داشتن نقطه جوش پایینتر از اسید استیک توسط تقطیر جداسازی میشوند. کاربرد اسید استیک به صورت سرکه به عنوان چاشنی غذا و تهیه انواع ترشی استفاده میشود.
اسید استیک رقیق
- به عنوان افشانه برای از بین بردن قارچهای گیاهان استفاده میشود.
- اسید استیک گلاسیال در صنایع شیمیایی در تولید فیلمهای عکاسی، تولید پلاستیک پلیاتیلن تریفتالات (PET) استفاده میشود.
- همچنین به عنوان ماده واسطه در تولید استات وینیل که ترکیب مهمی در تولید چسب و رنگ میباشد، کاربرد دارد.
- برخی از استرهای اسید استیک به عنوان حلال در تولید مواد معطر مصنوعی استفاده میشود.
- نکات ایمنی اسید استیک غلیظ مادهای خورنده میباشد. در تماس با پوست باعث سوختگی شیمیایی پوست و ایجاد تاول میشود.
- در صورت تماس با چشم میتواند آسیبهای جدی به چشم وارد کند، تنفس بخار غلیظ آن باعث سوزش دهان ، بینی و گلو میشود.
- هر چند سرکه یک مایع بدون ضرر میباشد اما نوشیدن اسید استیک گلاسیال خطرناک بوده و باعث ایجاد زخمهای شدید در دستگاه گوارشی میشود و ممکن است با تغییر اسیدیته خون آسیبهای جدی به سلامتی انسان وارد کند.
- خواص فیزیکی نام اسید استیک نام آیوپاک متان کربوکسیلیک اسید و اتانوئیکاسید وزن مولکولی ۶۰.۰۵gr/mol نقطه ذوب ۱۶.۵Cْ نقطه جوش ۱۱۸.۱Cْ دانسیته ۱.۰۵gr/cm۳
اسید آمینه
- اسید های آمینه واحدهای تشکیل دهنده پروتئینها هستند. اسیدههای آمینه در هنگام ساخته شدن پروتئینها از RNA ریبوزومی یا rRNA از روی بازهای نوکلیوتیدی ساخته می شوند.
- به هر سه باز نوکلیوتیدی که هنگام پروتئین سازی از RNA ریبوزومی اسید آمینه می سازد کودون می گویند.
- اسید نوکلئیک به زنجیرههای طویل مولکولی که از به هم پیوستن تعداد زیادی نوکلئوتید تشکیل شده است گفته میشود. اسیدهای نوکلئیک در همه جانداران یافت میشوند.
- اسیدهای نوکلئیک دو نوع هستند : آرانای RNA و دیانای (DNA) . در ساختن کروموزوم به کار میروند و از قند اکسی ریبوز و بازهای نیتروژنه و اسید فسفریک تشکیل شده اند.
- توسط این گیاهان ، زندگی ماهیها و دیگر آبزیان به خطر میافتد.
انواع ملات ضد اسید و قلیا
ملات پایه فوران
: ملات پایه فورانی SigaMent FU 630 رایج ترین و پر مصرف ترین نوع ملات ضد اسید و قلیا است و در شرایطی که سطح در معرض اسید و قلیاهای متنوع با غلظت های متداول قرار دارد، جهت نصب و بندکشی کاشی و آجر ضداسید و قلیا مورد استفاده قرار می گیرد.
SigaMent FU 630 افزون بر مقاومت شیمیایی بسیار بالا در برابر حلال ها و ترکیبات آلی، سرعت کاربری بالایی داشته و دارای خواص مکانیکی بسیار مطلوب نیز می باشد. این ملات فاقد Furfural بوده و تا دمای 180درجۀ سانتیگراد مقاومت حرارتی دارد.
ملات ضد اسید و قلیای SigaMent FU 630 افزون بر کاربرد وسیع در صنایع مختلف شیمیایی، در صنایع غذایی و داروئی نیز که دارای سیستم شستشوی CIP می باشند به صورت گسترده مورد استفاده قرار می گیرد. این ملات ها به صورت دو جزئی، شامل رزین و پودر حاوی فیلرهای معدنی و کاتالیزور می باشد.
هم چنین انواع دیگری از ملات های پایه فورانی با نام های تجاری SigaMent FU 631 و SigaMent FU 632 نیز ارائه می گردند. این ملاتها تقویت شده با فیلرهای کربنی می باشند که علاوه بر مقاومت شیمیایی از مقاومت ویژه ای در دماهای بالا (تا 220 درجۀ سانتیگراد) برخوردارند.
ملات پایه سیلیکاتی
ملات پایه سیلیکاتی SigaMent SP 660 جهت نصب و بندکشی کاشی و آجر در غلظت های بالای اسیدهایی مانند HCl، H2SO4، HNO3 و … با دمای عملیاتی بالا مورد استفاده قرار می گیرد. این ملات ها به صورت دو جزئی – رزین و پودر – ارائه می شوند.
همچنین ملات های SigaMent SP 665 و SigaMent SP 662 از انواع ملات های پایه سیلیکاتی تک جزئی بوده که پس از اختلاط با آب سخت می شوند. ملات پایه سیلیکاتی SigaMent SP 661 نیز از مقاومت حرارتی بالاتری نسبت به سایر ملات های معرفی شده برخوردار است.
ملات پایه فنولی
در شرایط حاد و بسیار خورنده شیمیایی و حرارتی که ملات های پایه فورانی و سیلیکاتی مقاومت نشان نمیدهند، ملاتهای پایه فنولی SigaMent PL 620 و SigaMent PL 621 ، به دلیل داشتن مقاومت خوردگی منحصر به فرد پیشنهاد می گردند. این ملات ها ضمن فراهم نمودن مقاومت شیمیایی فوق العاده، به دلیل داشتن فیلر های کربنی از مقاومت مکانیکی و حرارتی ویژه ای نیز برخوردارند.
ملات پایه وینیل استری
این نوع ملات ها در شرایط خورندگی ملایم شیمیایی و حرارتی مورد استفاده قرار می گیرند و در مقایسه با ملات های پایه فوران از مقاومت شیمیایی کمتری برخوردارند.
ملات پایه نوالاک وینیل استری SigaMent VE 640 به صورت دو جزئی و SigaMent VE 641 از انواع پر شده با فیلر های کربنی، به صورت سه جزئی قابل ارائه می باشند.
ملات پایه اپوکسی
ملات های SigaMent EP 672 ،SigaMent EP 673 و SigaMent EP 674 از انواع ملات های پایه اپوکسی SIGAS آلمان می باشند که نسبت به سایر ملات ها از مقاومت شیمیایی کمی برخوردارند. از مهم ترین مزایای این ملات ها می توان به چسبندگی بسیار مطلوب به سطح پایه اشاره کرد.
سنسور pH پرومیننت جهت اندازه گیری محدوده های مختلف pH در انواع آب مقطر تا آب صنعتی و پساب قابل ارائه است.
این سنسور با کنترلر بسیاری از انواع برندهای دیگر سازگار است.
سنسور pH در انواع مختلف آماده تحویل فوری است و در تهران موجود است.
شرکت مهار فن ابزار معمولا سنسورهای pH با این تایپ ها را برای تحویل سریعتر موجود دارد 1001586 150041
سنسورهای پتانسیومتری
سنسور pH یک سنسور پتانسیومتری است. این سنسورها معمولا از نوع الکترودهای شیشه ای و برای پارامترهای pH, ORP, Floride زیر می باشند.
خروجی سیگنال این سنسورها mV بوده و با استفاده از کابل مخصوص شیاردار تا فواصل ۱۰ متری قابل استفاده می باشند.


