انواع بیوراکتور ها

بیوراکتور
این مقاله نیاز به نقل قول های اضافی دارد تأیید . ( اکتبر 2010 ) |
. بیوراکتور به هر دستگاه یا سیستم ساخته شده ای گفته می شود که از یک محیط فعال بیولوژیکی پشتیبانی می کند [1] در یک مورد، بیوراکتور ظرفی است که در آن یک فرآیند شیمیایی انجام میشود که شامل ارگانیسمها یا بیوشیمیایی فعال مواد مشتق شده از چنین موجوداتی است. این فرآیند می تواند هوازی یا بی هوازی باشد. این بیوراکتورها معمولاً استوانهای هستند و اندازه آنها از لیتر تا متر مکعب متغیر است و اغلب از فولاد ضد زنگ ساخته . [ نیازمند منبع ] همچنین ممکن است به دستگاه یا سیستمی اشاره داشته باشد که برای رشد سلول ها یا بافت ها در زمینه کشت سلولی . [2] این دستگاهها برای استفاده در مهندسی بافت یا بیوشیمیایی / بیوشیمیایی . [ نیازمند منبع ]

بر اساس نحوه عملکرد، یک بیورآکتور ممکن است به عنوان دسته ای ، ای تغذیه شده یا پیوسته (مثلاً مدل راکتور مخزن همزن پیوسته ). نمونه ای از بیوراکتور پیوسته کیموستات است . [ نیاز به نقل ] بیوراکتورها بسیار غیرخطی هستند و بسیاری از استراتژیهای کنترل جدید برای کنترل آنها پیشنهاد شده است. [3]
موجوداتی که در بیوراکتورها رشد می کنند ممکن است در محیط مایع غوطه ور شوند یا ممکن است به سطح یک محیط جامد متصل شوند. کشت های غوطه ور ممکن است معلق یا بی حرکت شوند. بیوراکتورهای معلق می توانند از تنوع گسترده تری از ارگانیسم ها استفاده کنند، زیرا سطوح چسبندگی خاصی مورد نیاز نیست و می توانند در مقیاسی بسیار بزرگتر از کشت های بی حرکت کار کنند. با این حال، در فرآیندی که به طور مداوم کار می کند، موجودات زنده همراه با پساب از راکتور خارج می شوند. بیحرکتی یک اصطلاح کلی است که طیف گسترده ای از روش ها را برای اتصال یا به دام افتادن سلول یا ذره توصیف می کند. [4] اساساً می توان آن را برای همه انواع اعمال کرد بیوکاتالیز شامل آنزیم ها، اندامک های سلولی، سلول ها و اندام های حیوانی و گیاهی. [5] [6] بیحرکتی برای فرآیندهایی که به طور مداوم انجام میشوند مفید است، زیرا ارگانیسمها با پساب راکتور حذف نمیشوند، اما در مقیاس محدود است زیرا میکروبها فقط در سطوح ظرف وجود دارند.
بیوراکتورهای سلولی بی حرکت در مقیاس بزرگ عبارتند از:
- رسانه متحرک، همچنین به عنوان راکتور بیوفیلم بستر متحرک (MBBR) شناخته
- تخت بسته بندی شده
- تخت فیبری
- غشاء
طراحی
طراحی بیوراکتور یک کار مهندسی نسبتاً پیچیده است که در رشته بیوشیمی / بیو فرآیند شود. در شرایط بهینه، میکروارگانیسمها یا سلولها میتوانند عملکرد مورد نظر خود را با تولید محدود ناخالصی انجام دهند. شرایط محیطی داخل بیوراکتور مانند دما، غلظت مواد مغذی، pH و گازهای محلول (به ویژه اکسیژن برای تخمیرهای هوازی) بر رشد و بهره وری موجودات تاثیر می گذارد. دمای محیط تخمیر توسط یک ژاکت خنک کننده، کویل یا هر دو حفظ می شود. به خصوص تخمیرهای گرمازا ممکن است به استفاده از مبدل های حرارتی خارجی نیاز داشته باشد. مواد مغذی ممکن است به طور مداوم به تخمیر اضافه شوند، مانند یک سیستم تغذیه دسته ای، یا ممکن است در ابتدای تخمیر به راکتور شارژ شوند. PH محیط بسته به تخمیر با مقادیر کمی اسید یا باز اندازه گیری و تنظیم می شود. برای تخمیرهای هوازی (و برخی بی هوازی)، گازهای واکنش دهنده (به ویژه اکسیژن) باید به تخمیر اضافه شوند. از آنجایی که اکسیژن نسبتاً در آب نامحلول است (تقریباً اساس تمام محیط های تخمیر)، هوا (یا اکسیژن تصفیه شده) باید به طور مداوم اضافه شود. عمل حباب های در حال افزایش به مخلوط کردن محیط تخمیر کمک می کند و همچنین ” گازهای زائد مانند دی اکسید کربن را از بین می برد. در عمل، بیوراکتورها اغلب تحت فشار هستند؛ این امر حلالیت اکسیژن در آب را افزایش می دهد. در یک فرآیند هوازی، انتقال اکسیژن بهینه گاهی اوقات مرحله محدودکننده سرعت است. اکسیژن در آب کم محلول است. در آبگوشت های تخمیر گرم حتی کمتر – و در هوا (95/20%). انتقال اکسیژن معمولاً با هم زدن کمک می کند، که همچنین برای مخلوط کردن مواد مغذی و همگن نگه داشتن تخمیر لازم است. همزن های پخش کننده گاز برای شکستن حباب های هوا استفاده می شود. و آنها را در سرتاسر ظرف به گردش درآورید. [ نیازمند منبع ]
رسوب می تواند به کارایی کلی بیوراکتور، به ویژه مبدل های حرارتی . برای جلوگیری از آن، بیوراکتور باید به راحتی تمیز شود. سطوح داخلی معمولاً از فولاد ضد زنگ برای تمیز کردن و نظافت آسان ساخته می شوند. به طور معمول بیوراکتورها بین دستهها تمیز میشوند یا به گونهای طراحی میشوند که در صورت کار مداوم، رسوب را تا حد ممکن کاهش دهند. انتقال حرارت بخش مهمی از طراحی بیوراکتور است. ظروف کوچک را می توان با یک ژاکت خنک کننده خنک کرد، اما ظروف بزرگتر ممکن است به سیم پیچ یا مبدل حرارتی خارجی نیاز داشته باشند. [ نیازمند منبع ]
انواع
Photobioreactor

فوتوبیوراکتور PBR ) بیوراکتوری است که دارای نوعی منبع نور است (که ممکن است نور طبیعی خورشید یا نور مصنوعی باشد). تقریباً هر نیمه شفافی را می توان PBR نامید، با این حال این اصطلاح بیشتر برای تعریف یک سیستم بسته به کار می رود، برخلاف مخزن یا حوض . فتوبیوراکتورها برای رشد فوتوتروف مانند سیانوباکترها ، جلبک ها یا خزه گیاهان [7] این موجودات از نور از طریق فتوسنتز به عنوان انرژی منبع قند یا چربی به عنوان انرژی منبع در نتیجه، خطر آلودگی با ارگانیسمهای دیگر مانند باکتریها یا قارچها در فتوبیوراکتورها در مقایسه با بیوراکتورهای هتروتروف موجودات [ نیازمند منبع ]
تصفیه فاضلاب
معمولی تصفیه فاضلاب از بیوراکتورها برای انجام فرآیندهای اصلی تصفیه استفاده می کند. در برخی از این سیستم ها، یک محیط بی اثر شیمیایی با سطح بسیار بالا به عنوان بستری برای رشد فیلم بیولوژیکی ارائه می شود. جداسازی فیلم بیولوژیکی اضافی در مخازن ته نشینی یا سیکلون ها صورت می گیرد. در سیستمهای دیگر هوادهها اکسیژن را به فاضلاب و موجودات زنده میرسانند تا لجن فعال که در آن جزء بیولوژیکی آزادانه در مشروب در “لخته” مخلوط میشود. در این فرآیندها، نیاز بیوشیمیایی اکسیژن (BOD) به اندازه کافی کاهش می یابد تا آب آلوده برای استفاده مجدد مناسب شود. بیوسولیدها را می توان برای پردازش بیشتر جمع آوری کرد، یا خشک کرد و به عنوان کود استفاده کرد. یک نسخه بسیار ساده از بیوراکتور فاضلاب یک مخزن سپتیک است که به موجب آن فاضلاب در محل، با یا بدون رسانه اضافی برای نگهداری باکتری ها باقی می ماند. در این مثال، لجن زیستی خود میزبان اصلی باکتری است. [ نیازمند منبع ]
بیوراکتور برای بافت های تخصصی

بسیاری از سلولها و بافتها، بهویژه پستانداران، برای رشد باید دارای سطح یا سایر تکیهگاههای ساختاری باشند و محیطهای آشفته اغلب برای این نوع سلولها و بافتها مخرب هستند. ارگانیسم های بالاتر، به دلیل اکسوتروف ، به محیط های رشد بسیار تخصصی نیز نیاز دارند. هنگامی که هدف کشت مقادیر بیشتری از سلول ها برای اهداف تولید درمانی باشد، این یک چالش ایجاد می کند و طراحی متفاوتی در مقایسه با بیوراکتورهای صنعتی مورد استفاده برای رشد سیستم های بیان پروتئین مانند مخمر و باکتری مورد نیاز است. [ نیازمند منبع ]
بسیاری از گروههای تحقیقاتی بیوراکتورهای جدیدی را برای رشد بافتها و سلولهای تخصصی بر روی یک داربست ساختاری، در تلاش برای بازسازی ساختارهای بافتی انداممانند در شرایط آزمایشگاهی . از جمله بیوراکتورهای بافتی که میتوانند بافت قلب را رشد دهند، [8] [9] بافت ماهیچهای اسکلتی، [10] رباطها، مدلهای بافت سرطانی و دیگران. در حال حاضر، تولید مقیاس این بیوراکتورهای تخصصی برای استفاده صنعتی چالش برانگیز است و یک منطقه فعال تحقیقاتی است.
برای اطلاعات بیشتر در مورد کشت بافت مصنوعی، به مهندسی بافت .
مدلسازی
مدل های ریاضی به عنوان یک ابزار مهم در کاربردهای مختلف بیو راکتور از جمله تصفیه فاضلاب عمل می کنند. این مدل ها برای برنامه ریزی کنترل فرآیند و پیش بینی عملکرد کارخانه در آینده مفید هستند. علاوه بر این، این مدل ها در زمینه های آموزشی و پژوهشی مفید هستند. [ نیازمند منبع ]
بیوراکتورها عموماً در صنایعی استفاده میشوند که با مواد غذایی، نوشیدنیها و داروسازی سروکار دارند. ظهور مهندسی بیوشیمی منشا اخیری دارد. پردازش مواد بیولوژیکی با استفاده از عوامل بیولوژیکی مانند سلول ها، آنزیم ها یا آنتی بادی ها از ارکان اصلی مهندسی بیوشیمی هستند. کاربردهای مهندسی بیوشیمی زمینه های عمده تمدن مانند کشاورزی، غذا و مراقبت های بهداشتی، بازیابی منابع و مواد شیمیایی خوب را پوشش می دهد. [ نیازمند منبع ]
تاکنون، صنایع مرتبط با بیوتکنولوژی در اجرای کنترل فرآیند و استراتژیهای بهینهسازی از سایر صنایع عقب ماندهاند. [3] یک اشکال اصلی در کنترل فرآیند بیوتکنولوژیکی، مشکل اندازهگیری پارامترهای فیزیکی و بیوشیمیایی کلیدی است. [11]
مراحل عملیاتی در یک فرآیند زیستی
یک فرآیند زیستی عمدتاً از سه مرحله – پردازش بالادستی، واکنش زیستی و پردازش پایین دست – برای تبدیل مواد خام به محصول نهایی تشکیل شده است. [12]
ماده اولیه می تواند منشأ بیولوژیکی یا غیر بیولوژیکی داشته باشد. ابتدا به فرم مناسب تری برای پردازش تبدیل می شود. این در یک مرحله پردازش بالادستی انجام می شود که شامل هیدرولیز شیمیایی، تهیه محیط مایع، جداسازی ذرات، تصفیه هوا و بسیاری از عملیات های آماده سازی دیگر است. [ نیازمند منبع ]
پس از مرحله پردازش بالادست، خوراک حاصل به یک یا چند مرحله بیوراکشن منتقل می شود. راکتورهای بیوشیمیایی یا بیوراکتورها پایه مرحله بیورواکنش را تشکیل می دهند. این مرحله عمدتاً شامل سه عملیات تولید زیست توده ، بیوسنتز متابولیت و تبدیل زیستی است. [ نیازمند منبع ]
در نهایت، مواد تولید شده در بیوراکتور باید بیشتر در بخش پایین دست پردازش شوند تا به شکل مفیدتری تبدیل شوند. فرآیند پایین دستی عمدتاً شامل عملیات جداسازی فیزیکی است که شامل جداسازی مایع جامد، جذب سطحی ، استخراج مایع-مایع ، تقطیر ، خشک کردن و غیره است
مشخصات
یک بیوراکتور معمولی از بخش های زیر تشکیل شده است:
همزن – برای اختلاط محتویات راکتور استفاده می شود که سلول ها را در شرایط همگن کامل برای انتقال بهتر مواد مغذی و اکسیژن به محصول(های مورد نظر) نگه می دارد.
بافل – برای شکستن تشکیل گرداب در کشتی استفاده می شود که معمولاً بسیار نامطلوب است زیرا مرکز ثقل سیستم را تغییر می دهد و انرژی اضافی مصرف می کند.
اسپارگر – در فرآیند کشت هوازی، هدف اسپارگر تامین اکسیژن کافی به سلولهای در حال رشد است.
ژاکت – ژاکت ناحیه حلقوی را برای گردش دمای ثابت آب فراهم می کند که دمای بیوراکتور را در یک مقدار ثابت نگه می دارد. [14]
بیوراکتورها
IV نتایجی که اظهار شده
جزء بیوراکتور ضروری هر فرآیند زیستی است، صرف نظر از اینکه فرآیند، آلایندهها را تجزیه میکند یا موادی مانند غذاها، خوراکها، مواد شیمیایی و دارویی، و بافتها و اندامها را برای استفاده در بیوپزشکی تولید میکند. تنوع فرآیندهای زیستی بسیار زیاد است و طرحهای مختلفی از بیوراکتورها برای رفع نیازهای مختلف توسعه یافتهاند. در تمام موارد، بیوراکتور باید شرایط محیطی لازم برای کشت را فراهم کند. خواسته های خاص اغلب متناقض هستند و دستیابی به عملکرد بهینه مستلزم دستیابی به تعادل مناسب بین الزامات مختلف است. موفقیت یک فرآیند زیستی به طور اساسی به طراحی و عملکرد خوب بیوراکتور بستگی دارد.
مبانی مهندسی بیوتکنولوژی
2.25.6.1 ویژگی های اساسی بیوراکتورهای تحریک شده با هوادهی اجباری
هوادهی نیرومند بیوراکتورهای (FAABs)، هوا با قدرت به داخل بستر دمیده میشود، به گونهای که باید از طریق فضاهای بین ذرهای جریان یابد تا از بیوراکتور خارج شود، همانطور که در مورد بیوراکتور با بستر پر شده است. تفاوت با تخت های بسته بندی شده در این است که بستر یک FAAB به طور مداوم یا مکرر هم زده می شود.
طرحهای بیوراکتورهای مختلفی وجود دارد که همزن و هوادهی اجباری را با هم ترکیب میکنند و بیوراکتورهای مختلفی در مقیاس بزرگ از این نوع ساخته شدهاند. همانطور که در بخش 2.25.4.1 سس سویا استفاده کوجی ، امکان اختلاط متناوب [1] . چنین بیوراکتورهایی را می توان با اختلاط مکرر استفاده کرد. در این حالت عملکرد آنها به عنوان FAABs طبقه بندی می شوند. یک بیوراکتور با ظرفیت حدود 1 تن بستر در مؤسسه ملی de la Recherche Agronomique یا موسسه ملی تحقیقات زراعی (INRA) در دیژون، فرانسه [3] ساخته شد. این بیوراکتور طراحی معمولی یک بیوراکتور با بستر بسته بندی شده دارد، با این تفاوت که بستر توسط مجموعه ای از پیچ های نصب شده بر روی کالسکه ای که روی ریل های بالای بستر قرار دارد و به طور مداوم از یک سر بیوراکتور به انتهای دیگر حرکت می کند مخلوط می شود ( شکل 6 ). اگرچه پیچ ها به طور مداوم کار می کنند، هر قسمت از بستر فقط به طور متناوب به هم می زند. اگرچه بیوراکتورهای SSF بستر سیال گزارش شده است، اطلاعات بسیار کمی در دسترس است و در اینجا مورد بحث قرار نخواهد گرفت.
شکل 6 . یک بیوراکتور با هوادهی شدید و متناوب.
جلد 1
تکنیک های فرهنگ بیوراکتور
بیوراکتور می تواند به بهبود استحکام و سازگاری زیستی پیوندهای عروقی مهندسی شده با تحریک سلول های بذر با یک محیط فیزیولوژیکی مرتبط برای مدت زمان طولانی کمک کند. در مقایسه با کشت استاتیک، کشت بیوراکتور مزایای زیادی مانند محدودیتهای انتقال جرم کمتر و تحریک مکانیکی قوی ارائه میکند. هم سلول های اندوتلیال و هم سلول های ماهیچه صاف عروقی را می توان با استفاده از نیروهای بیومکانیکی تعدیل کرد. برای سلولهای اندوتلیال، تنش برشی منجر به پاسخهای متعددی مانند ازدیاد طول، افزایش همترازی و کاهش تکثیر میشود. برای سلول های ماهیچه صاف، کشش بیومکانیکی برای حفظ فنوتیپ انقباضی سالم مورد نیاز است. SMCها در ریزنمونههای عروقی کشتشده استاتیکی توانایی انقباض را از دست میدهند و افزایش تکثیر را تجربه میکنند. استفاده از طراحی بیوراکتور برای تحریک مکانیکی این نوع سلول ها می تواند عملکرد سلول و بافت را بهبود بخشد.
کشت بیوراکتور با تحریک مکانیکی برای پیوند عروقی با موفقیت توسط نیکلاسون و لانگر در سال 1997 استفاده شد. برای این مطالعه، داربست های عروقی PGA آغشته به SMC های گاوی در داخل یک بیوراکتور تا 8 کشت داده شدند. هفته ها با پیچاندن داربست عروقی در اطراف یک لوله سیلیکونی قابل انبساط، کشش ضربانی بیومیمتیک روی مش اعمال شد تا SMC ها را تحت فشار قرار دهد و آنها را برای تولید کلاژن تحریک کند. این روش رگ هایی با استحکام رگ بالاتر نسبت به رگ های کنترل استاتیکی تولید کرد. فشار پشت سر هم و انطباق حاصل از پیوندهای عروقی تحریک شده مکانیکی قابل مقایسه با SVهای بومی است. این رگها همچنین در داخل بدن از طریق کاشت در خوکهای کوچک یوکاتان آزمایش شدند و توانستند تا 24 مورد ثبت اختراع باقی بمانند. روزها. از آن زمان، بسیاری از مطالعات از تکنیکهای مشابهی برای آمادهسازی عروق در شرایط آزمایشگاهی قبل از استفاده از آنها به عنوان پیوند قابل پیوند استفاده کردهاند.
سایر بیوراکتورها از استفاده از لوله سیلیکونی در لومن اجتناب می کنند و در عوض از جریان محوری برای پرفیوژن مستقیم پیوند عروقی مهندسی شده استفاده می کنند. گروه Tranquillo مطالعاتی در مورد چگونگی کمک جریان محوری به اکسیژن رسانی در سیستم بیوراکتور خود انجام داده است. با افزایش فشار در لومن، جریان transmural نیز می تواند از طریق دیواره رگ بخیه شده رخ دهد. ترکیبی از هر دو نوع جریان منجر به بهبود یکنواختی اکسیژن محلول می شود. با ترویج تنفس هوازی، بیوراکتورهای کاشته شده با SMC ها نشان داده شده است که زنده ماندن SMC بهبود یافته و بیان mRNA کلاژن را افزایش می دهند. یک بیوراکتور توسعه یافته توسط شولت و همکاران. بذر، تهویه، و پرفیوژن را به طور همزمان در یک بیوراکتور از طریق افزودن یک دستگاه بذر ترکیب می کند. EC ها و فیبروبلاست ها بر روی لوله های پلی اورتان در بیوراکتور و اعمال تنش برشی گام به گام تا 40 کاشته شدند. dyn/cm 2 یک لایه سلولی همرو ایجاد کرد.
با توجه به شرایط بیوراکتور، تغییراتی در محیط، مواد داربست، و انواع سلول وجود دارد. علاوه بر این، بزرگی و فرکانس اتساع چرخه ای را نیز می توان تغییر داد. به طور کلی، پیوندهایی که در داخل بیوراکتورها کشت میشوند، بهتر از عروق کشتشده استاتیکی عمل میکنند، زیرا کشت بیوراکتور اجازه میدهد بازسازی در پیوندهای مهندسی شده در شرایط آزمایشگاهی را تشویق کند. در حالی که استفاده از بیوراکتورها زمان مورد نیاز برای تولید گرافت های عروقی را افزایش می دهد، این یک گام مهم برای استفاده از پیوندهای مملو از سلول است و ممکن است بتوان تولید بیوراکتور را برای ایجاد بسیاری از پیوندهای عروقی به طور همزمان افزایش داد.
بیوتکنولوژی صنعتی و محصولات کالایی
بیوراکتورها رگ هایی هستند که طراحی و تولید شده اند تا محیط موثری را برای آنزیم ها یا سلول های کامل برای تبدیل مواد بیوشیمیایی به محصولات فراهم کنند. در برخی موارد، غیر فعال سازی سلول ها یا عقیم سازی در بیوراکتور مانند تصفیه آب انجام می شود. بسیاری از بیوراکتورها و کاربردهای بیوراکتور مختلف، از جمله مواردی برای رشد سلولی، تولید آنزیم، بیوکاتالیز، حسگرهای زیستی، تولید غذا، پردازش شیر، اکستروژن، مهندسی بافت، تولید جلبک، سنتز پروتئین و هضم بیهوازی توصیف شدهاند. روشهایی برای طبقهبندی بیوراکتورها از جمله شرایط عملیاتی و ماهیت فرآیند ارائه شدهاند. برای اینکه خواننده بتواند اطلاعات بیشتری در مورد هر یک از انواع بیوراکتورها و محصولات انتخابی پیدا کند، منابعی گنجانده شده است. تاکید بر راکتورهایی است که به صورت تجاری تولید می شوند تا راکتورهایی که در دنیای طبیعی تکامل یافته اند. بیوراکتورهای مورد استفاده برای سنتز DNA و پروتئین (سنتی سایزرهای زیست مولکولی) شامل می شوند. محصولات کالایی شامل کلیه موادی است که در بیوراکتورها تولید و به بازار عرضه می شوند. با این حال، تاکید بر اصول کلی و انواع و محصولات بیوراکتور پرکاربردتر است.
تصفیه فاضلاب و استفاده مجدد
3.13.5.3.2.2.3 بیوراکتورهای غشایی (MBRs)
MBRها اجزای لجن فعال هستند که از واحدهای فیلتراسیون غشایی برای جداسازی زیست توده از پساب استفاده می کنند ( فصل 3.8 برای جزئیات برخلاف پیکربندی های رشد معلق که قبلاً ذکر شد (به بخش 3.13.5.3.2.2.1 مراجعه کنید)، MBR ها برای جداسازی زیست توده و پساب به گرانش (ته نشین شدن) وابسته نیستند. با فیلتراسیون غشایی، زمان و فضای مورد نیاز برای جداسازی زیست توده محدودیت کمتری دارد. بنابراین سیستم های MBR می توانند حجم بیشتری از آب را تصفیه کنند و فضای کمتری را نسبت به سیستم های رشد معلق معمولی اشغال کنند. با این حال، افزایش ظرفیت تصفیه با افزایش هزینه الکتریکی همراه است، زیرا ظرفیت هوادهی و فشار بیشتر برای عملکرد یک MBR در پتانسیل کامل آن مورد نیاز است. برای انجام حذف نیتروژن و فسفر، فرآیندهای واحد اضافی باید به فرآیند MBR اضافه شود.
دیدگاه های مهندسی در بیوتکنولوژی
خلاصه
بیوراکتور هسته فرآیندهای بیولوژیکی است. سیستمهای بیولوژیکی درگیر شامل آنزیمها، میکروارگانیسمها، سلولهای حیوانی، سلولهای گیاهی و بافتها هستند. برای طراحی یک بیوراکتور مناسب برای یک فرآیند زیستی خاص، مطالعات فشرده بر روی سیستم بیولوژیکی، مانند رشد سلول، متابولیسم، دستکاری ژنتیکی، و بیان پروتئین یا سایر محصولات، مورد نیاز است تا نیاز سلول ها به محیط فیزیکی و شیمیایی آنها را درک کنیم. همچنین کنترل و بهینه سازی محیط زیست راکتور از طریق متغیرهای عملیاتی به منظور به نفع عملکردهای مورد نظر سلول ها و دستیابی به تولید مقرون به صرفه در مقیاس بزرگ ضروری است. در این مقاله اصول طراحی اساسی و انواع مختلف بیوراکتورها از جمله بیوراکتورهای مخزن همزده، همزن پنوماتیک، غشایی، بستر ثابت و سیال و بیوراکتورهای موجی بررسی شده است. اثرات متغیرهای فرآیند بر عملکرد بیولوژیکی، مانند دما، pH، اختلاط، انتقال اکسیژن و نیروی برشی مورد بحث قرار میگیرد. استراتژی های عملیات بیوراکتور شامل کشت های تغذیه دسته ای، پیوسته، نیمه پیوسته و پرفیوژن است. برای کاربرد صنعتی بیوراکتورها، افزایش مقیاس بیوراکتور، مطالعه چند مقیاسی، و نظارت بر فرآیندهای زیستی، مدلسازی و شبیهسازی نیز بسیار مهم است. در نهایت، روندها در مهندسی بیوراکتور، از جمله میکروبیوراکتور، سلول به عنوان یک بیوراکتور فوق العاده، و گیاه و حیوان به عنوان بیوراکتورهای قوی تولید کننده پروتئین، به طور خلاصه خلاصه می شود.
دیدگاه های مهندسی در بیوتکنولوژی
2.26.7 نتیجه گیری
SUB ها عموماً توسط صنعت و آزمایشگاه های دانشگاهی پذیرفته شده اند، عمدتاً به دلیل مزایای آنها، از جمله سهولت استفاده، انعطاف پذیری و هزینه. به طور کلی دو نوع بیوراکتور موجود است: بیوراکتورهایی با کیسه های بالشی شکل که در آن اختلاط و انتقال جرم توسط یک حرکت موجی سیال القا می شود و به اصطلاح SUB ها، دارای کیسه های مخزن مجهز به همزن های یکبار مصرف که بیشتر شبیه سازی می کنند. از نظر عملیاتی، بیوراکتورهای همزن سنتی. مزیت اصلی SUB ها انعطاف پذیری و مقیاس پذیری آنها در مقایسه با بیوراکتورهای همزن استاندارد است. نتایج با سلولهای CHO و سلولهای PER.C6 پتانسیل عالی خود را در کشت سلولی نشان میدهند، اما به دلیل ظرفیت انتقال جرم کم، SUBها فقط برای کشت سلولی مناسب هستند. راکتورها از تامین کنندگان مختلف در محدوده 50 تا 2000 لیتر حجم کاری در دسترس هستند. بیوراکتورهای بالشی شکل عمدتاً در مقیاس های کوچکتر تا 100 لیتر استفاده می شوند. حجم های بزرگتر در این نوع کیسه ها کمتر کاربردی است. با این حال، بیوراکتورهای نوع راک به طور گسترده ای پذیرفته شده و در صنعت بیوداروسازی مورد استفاده قرار می گیرند. کشت در بیوراکتورهای نوع گهواره ای منجر به عملکرد قابل مقایسه با راکتورهای استاندارد (در مقیاس کوچک) شیشه هم زده یا فولاد ضد زنگ می شود.
بیوراکتور CELL-tainer، با اعمال یک حرکت تکان دهنده دو بعدی، پتانسیل استفاده از SUB را نه تنها در کاربردهای کشت سلولی فشرده (مانند پرفیوژن یا فرآیند XD از DSM Biologics) بلکه در کشت های میکروبی، مخمری و قارچی فراهم می کند. به دلیل توانایی آن در انتقال جرم بالا. این امر کاربرد بیوراکتورهای یکبار مصرف را حتی در فرآیندهای بیوتکنولوژی سنتی تر گسترش می دهد.
در حالی که بسیاری از این بخش بر روی فناوریهای بیوراکتور یکبار مصرف خاص که در حال حاضر در بازار هستند متمرکز شدهاند، شاید نتیجهگیری کلیدی که میتوان از این اطلاعات گرفت این باشد که یک روند قطعی به سمت استفاده از وسایل دور ریختنی وجود دارد. با افزایش سطح پذیرش و بازار فناوری های یکبار مصرف، تعداد شرکت هایی که محصولات جدید ارائه می دهند نیز افزایش یافته است. میتوان پیشبینی کرد که فناوریهای یکبار مصرف جدید و بهبودیافته به طور مداوم ظهور کنند و امکان پیادهسازی در مناطقی را فراهم کنند که در حال حاضر فراتر از دسترس فناوریهای یکبار مصرف امروزی هستند.
مبانی مهندسی بیوتکنولوژی
2.27.5 نتایجی که اظهار شده
بیوراکتورها یک عنصر اصلی هستند و مورد کشت سلولی حیوانی نیز از این قاعده مستثنی نیست. برای تولید متابولیت های محلول ترشح شده توسط سلول های حیوانی، بیوراکتورهای سلولی حیوانی بر اساس پیکربندی های توسعه یافته برای فرآیندهای میکروبی طراحی شده اند. از نقطه نظر عملی، ویژگی های عمده ای که باید در نظر گرفته شود، شکنندگی مکانیکی و سرعت رشد کم سلول های حیوانی است. این محدودیتها به استراتژی کشت با تراکم سلولی بالا با نگه داشتن سلولها در بیوراکتورها با جریان محیط خارجی منجر شد. از سوی دیگر، در دهه های اخیر، فناوری هایی برای درمان سلولی و بافتی در زمینه پزشکی بازساختی پدیدار شده است. برای چنین اهدافی، اهداف بدن و گسترش سلول های انسانی در حالت های تمایز نیافته یا تمایز یافته است، جایی که محصولات مورد نظر خود سلول ها و/یا بافت هستند. بنابراین، بیوراکتور مورد استفاده در این کشتها باید تحت شرایط کاملاً کنترلشده برای تولید سلولها یا بافتهایی با کیفیت و عملکردهایی که نیازهای بالینی خاص را برآورده میکنند، کار کند. سیستمهای بیوراکتور پیچیده، فرآیندهای قابلتولید و قابل اعتمادی را برای کشتهای سلولی و بافتی انسانی با ترکیب کنترل خودکار سلولها و مواد مغذی، و همچنین نظارت بر پارامترهای سلولی و وضعیت فرآیند ارائه میدهند.
اصل کار بیوراکتورهای معمولی
10.1 معرفی
دستگاهی بیوراکتور شبیه رگ است که زمینه یکنواختی را برای رشد میکروارگانیسم ها فراهم می کند و تعادل بی وقفه ای را در واکنش های بیوشیمیایی انجام شده توسط این میکروارگانیسم ها برای تولید متابولیت های مورد نظر حفظ می کند [1] . کاربرد بیوراکتورها ممکن است برای تولید زیست توده مانند پروتئین تک سلولی، مخمر نانوایی، سلول های حیوانی و ریزجلبک ها و همچنین برای تشکیل متابولیت ها مانند اسیدهای آلی، اتانول، آنتی بیوتیک ها، ترکیبات معطر و رنگدانه ها و برای تبدیل بسترهایی مانند استروئیدها و … گسترش یابد. حتی برای تولید آنزیم های داخل و خارج سلولی [2] .
بیوراکتور قلب هر فرآیند بیوشیمیایی است زیرا محیط دقیقی را برای میکروارگانیسمها فراهم میکند تا به رشد مطلوب دست یابند و متابولیتها را تولید کنند [3] . به عبارت دیگر، برای تبدیل زیستی و تبدیل زیستی بسترها به محصولات مطلوب، راکتورها را می توان بر اساس نیازهای رشد موجودات مورد استفاده مهندسی یا ساخت. آنها می توانند برای همه انواع بیوکاتالیز از جمله تولید آنزیم ها و رشد بافت ها، سلول ها و اندامک های سلولی استفاده شوند. بیوراکتورها معمولاً به عنوان یک مخزن استوانهای با یک همزن و سیستم گرمایش یا سرمایش یکپارچه طراحی میشوند که اندازه آنها از کمتر از 1 متغیر است. L به بیش از 50000 L، اغلب از فولاد، فولاد ضد زنگ، فولاد با روکش شیشه ای یا شیشه ساخته شده است.
این راکتورها برای حفظ پارامترهای خاصی مانند نرخ جریان، هوادهی، دما، pH، کنترل کف و سرعت همزدن طراحی شدهاند. راکتورها می توانند یک خروجی برای عناصر کنترل پارامتر فرآیند مشخص شده برای اصلاح هر گونه انحراف در مقدار این پارامترها از نقطه تنظیم تعریف شده توسط کاربر ارائه دهند. تعداد پارامترهایی که می توان نظارت و کنترل کرد با تعداد حسگرها و عناصر کنترلی که در یک بیوراکتور معین گنجانده شده اند محدود می شود [4] .
بیوراکتورها به طور کلی به دو دسته کلی تقسیم می شوند:
- •بیوراکتورهای رشد معلق، که از متابولیسم میکروبی در شرایط هوازی، بی هوازی یا بی هوازی/هوازی متوالی برای استفاده از بسترها و تجزیه آنها به باقیمانده ها استفاده می کنند. به عنوان مثال می توان به راکتورهای دسته ای، راکتورهای مخزن همزن پیوسته (CSTR) و راکتورهای جریان پلاگین و غیره اشاره کرد.
- •بیو راکتورهای بیوفیلم که در آنها میکروارگانیسمها بیشتر به یک سطح متصل میشوند و در داخل راکتور میچسبند، که میتوان از آن برای تصفیه فاضلاب استفاده کرد و موجودات موجود در بیوفیلم، مواد سمی موجود در آب را جذب و تجزیه میکنند. به عنوان مثال می توان به راکتورهای غشایی، بستر سیال، بستر بسته، انتقال هوایی و راکتورهای لجن بی هوازی بالا (UASB) اشاره کرد.
راکتورهای زیستی را میتوان بر اساس نحوه عملکرد مورد استفاده به سه نوع طبقهبندی کرد، عمدتاً مکانیسم تغذیه کشت و محیط به راکتور، یعنی دستهای، پیوسته و نیمه پیوسته یا تغذیه دستهای [5] . کاربرد فرآیندهای دسته ای در زمینه های مربوط به تولید بیومولکول ها و داروها و غیره افزایش یافته است.
صنایع باید بیوراکتورها را بر اساس تولید کارآمد بیوانرژی از طریق زیست توده و سوخت زیستی و محدود کردن آلایندههای تولید شده از فرآیندها انتخاب کنند. بر اساس نیازهای صنعتی، انواع مختلف بیوراکتورها به همراه اصول کار و کاربرد آنها مورد بحث قرار می گیرد.
دیدگاه های مهندسی در بیوتکنولوژی
خلاصه
بیوراکتورها یک عنصر اصلی برای تولید مواد با ارزش بالا در فرآیندهای بیولوژیکی با استفاده از سلول های حیوانی هستند. در کشت سلولهای حیوانی، ویژگیهای اصلی شکنندگی مکانیکی و سرعت رشد پایین این سلولها است که منجر به استراتژی کشت با تراکم سلولی بالا با حفظ سلولها در بیوراکتورها با جریان محیط خارجی میشود. در دهههای اخیر، فناوریهایی برای درمان سلولی و بافتی در زمینه پزشکی بازساختی پدیدار شدهاند. برای چنین اهدافی، اهداف گسترش خارج از بدن سلول های انسانی در حالت تمایز نیافته یا تمایز یافته است، جایی که محصولات مورد نظر خود سلول ها و/یا بافت هستند. بنابراین، بیوراکتور مورد استفاده در این کشتها باید تحت شرایط کاملاً کنترلشده برای تولید سلولها یا بافتهایی با کیفیت و عملکردهایی که نیازهای بالینی خاص را برآورده میکنند، کار کند. این مقاله طرح کلی بیوراکتورها را برای سلولها و بافتهای حیوانی کشتشده، شامل اصول اساسی، ملاحظات مهندسی، و استراتژیهای افزایش یا کاهش مقیاس در بیورآکتورهای مختلف، از جمله پیشرفتهای اخیر در سیستمهای بیوراکتور خودکار برای پردازش سلولی و بافتی، شرح میدهد.
توسعه سیستمهای کنترل بیوراکتور جدید مبتنی بر حسگرها و محرکهای هوشمند
- 1 گروه مهندسی بیوشیمی، دانشکده مهندسی شیمی و فناوری، دانشگاه تیانجین، تیانجین، چین
- 2 پلت فرم تحقیقاتی SynBio، مرکز نوآوری مشترک علوم و مهندسی شیمی (تیانجین)، تیانجین، چین
- 3 مرکز علوم مرزی برای زیست شناسی مصنوعی و آزمایشگاه کلیدی مهندسی زیستی سیستم ها (MOE)، دانشکده مهندسی شیمی و فناوری، دانشگاه تیانجین، تیانجین، چین
بیوراکتورها در اشکال مختلف به طور گسترده در حفاظت از محیط زیست، مراقبت های بهداشتی، بیوتکنولوژی صنعتی و اکتشافات فضایی استفاده شده اند. تقاضای قوی در این زمینه توسعه طرحهای جدید هندسههای بیوراکتور و استراتژیهای کنترل فرآیند و تکامل ساختار فیزیکی سیستم کنترل را تحریک کرد. پس از معرفی کامپیوترهای دیجیتال به کنترل فرآیند بیوراکتور، یک سیستم کنترل ساختار سلسله مراتبی (HSCS) برای بیورآکتورها به ساختار فیزیکی غالب تبدیل شده است که بازده و استحکام بالایی دارد. با این حال، اشکالات ذاتی HSCS برای بیوراکتورها نیاز به یک راه حل یکپارچه تر از سیستم کنترل را ایجاد کرده است. با پیشرفت سریع در حسگرها، ماشینآلات و فناوری اطلاعات، توسعه یک سیستم کنترل سازمانی مسطح (FOCS) برای بیورآکتورها بر اساس سنسورها و محرکهای هوشمند توزیعشده موازی ممکن است راهحل مختصرتری برای کنترل فرآیند در بیوراکتورها ارائه دهد. در اینجا، تکامل ساختار فیزیکی سیستمهای کنترل بیوراکتور را بررسی میکنیم و ویژگیهای FOCS جدید را برای بیورآکتورها و حسگرها و محرکهای هوشمند مرتبط و شرایط کاربرد آنها، با امید به بهبود بیشتر کارایی، استحکام و اقتصادی فرآیند زیستی مورد بحث قرار میدهیم. کنترل.
معرفی
تاریخچه توسعه بیوراکتور به قدمت استفاده از میکروارگانیسم ها توسط فرهنگ های باستانی برای تخمیر و بهبود غذاها و نوشیدنی ها است. از زمان اختراع تخمیر غوطهور، بیوراکتورها کاربردهای گستردهای در زمینههای مختلف از جمله تصفیه فاضلاب در بخش حفاظت از محیط زیست، کشت سلولی و مهندسی بافت در بخش مراقبتهای بهداشتی، تولید داروهای با ارزش بالا و مواد شیمیایی فله در بیوتکنولوژی صنعتی و حتی پیدا کردهاند. کشت جلبک برای تولید اکسیژن در اکتشاف فضایی ( Li X. و همکاران، 2016 ؛ Pirasaci و همکاران، 2017 ؛ Zhuo و همکاران، 2018 ؛ Christoffersson and Mandenius، 2019 ). تقاضای شدید برای کاربردهای مختلف باعث پیشرفت در طراحی ساختار بیوراکتور برای تحقق اهداف خاص شد، مانند بیورآکتورهای تخمیر حالت جامد مورد استفاده در صنعت دم کردن نوشیدنی الکلی چین (Baijiu)، بیورآکتورهای غشایی بی هوازی برای تصفیه فاضلاب، بیوراکتورهای کلاسیک مخزن مورد استفاده در صنعت تخمیر. و بیوراکتورهای ارزان قیمت یکبار مصرف اخیراً برای تولید در مقیاس کوچک داروهای بیولوژیکی با ارزش بالا ( ژو و همکاران، 2018 ; فانگ و همکاران، 2019 ؛ متزه و همکاران، 2019 ).
علاوه بر توسعه طرحهای جدید هندسه بیوراکتور،
سیستمهای کنترل مربوطه نیز نقش مهمی در توسعه بیوراکتورها ایفا کردهاند. به طور کلی، وظایف اصلی یک سیستم کنترل بیوراکتور شامل کنترل فرآیند، نظارت، جمع آوری داده ها و پردازش است. تحقیقات فعلی در مورد سیستمهای کنترل بیوراکتور را میتوان به دو جنبه دستهبندی کرد، با برخی از مطالعات تمرکز بر استراتژیهای کنترل و الگوریتمهای سازگار با سیستمهای کنترل بیوراکتور، در حالی که برخی دیگر عمدتاً ساختار فیزیکی سازمان ابزاری سیستمهای کنترل بیوراکتور را بررسی میکنند ( شکل 1 ). تحقیقات در مورد استراتژیها و الگوریتمهای کنترلی اتخاذ شده در سیستمهای کنترل بیوراکتور عمدتاً بر مشکلات مربوط به پارامترهای نظارتی که نمیتوان مستقیماً اندازهگیری کرد، روشهای کنترل مؤثر و پایدار مبتنی بر نظارت بر دادههای فرآیند و کاربرد موفقیتآمیز دادههای فرآیند برای بهبود تمرکز دارد. فرآیندهای آینده (مانند مدل سازی فرآیندهای زیستی پویا). همچنین پیشرفت قابل توجهی در توسعه استراتژی های کنترل، الگوریتم های بهینه سازی جدید و چارچوب های نرم افزاری برای سیستم های کنترلی حاصل شد. این موضوعات موضوع بررسی های عالی دیگری نیز بوده است ( سیموتیس و لوبرت، 2015 ; نارایانان و همکاران، 2019 ; Steinwandter و همکاران، 2019 ; Steinwandter and Herwig، 2019 ) و در اینجا به طور عمیق مورد بحث قرار نخواهد گرفت. تحقیقات در مورد ساختار فیزیکی سیستمهای کنترل بیوراکتور عمدتاً با مسائل مربوط به توسعه و کاربرد حسگرهای جدید برای اندازهگیری پارامترهای فرآیند فیزیکی، شیمیایی و فیزیولوژیکی، محرکهای مورد استفاده در کنترل فرآیند و امکانات برای جمعآوری و پردازش دادهها سروکار دارد. همراه با استفاده از کامپیوترهای دیجیتال در کنترل فرآیند بیوراکتور و ظهور استراتژی ها و الگوریتم های کنترلی پیشرفته، چندین ساختار فیزیکی مهم از سیستم های کنترل بیوراکتور توسعه یافته است. اولی HSCS کلاسیک است که از زمان اختراع خود به ساختار فیزیکی غالب سیستم های کنترل بیوراکتور تبدیل شده است ( Rolf et al., 1982 ). متعاقبا، کنترل فیلدباس و NCSهای جدید توسعه یافتند که هر دو را می توان به عنوان FOCS توصیف کرد و به دنبال آن KBCS اخیرا توسعه یافته ( کوهوت و همکاران، 2015) ; ون لون، 2015 ; ابراهیم و همکاران، 2018 ). همراه با استفاده از حسگرها و محرکهای هوشمند، این سیستمهای کنترل بیوراکتور جدید میتوانند تأثیر عمیقی بر کنترل فرآیندهای زیستی در آینده نزدیک داشته باشند.
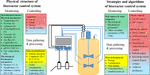 شکل 1. خلاصه تحقیقات در مورد سیستم های کنترل بیوراکتور. S، سنسورهای عملکردی خاص؛ O، سنسورهای نوری؛ آشکارسازهای آنلاین مبتنی بر ام اس. B، بیوسنسورها؛ DO، اکسیژن محلول؛ ORP، پتانسیل کاهش اکسیداسیون؛ PLC، کنترل کننده منطقی قابل برنامه ریزی؛ DCS، سیستم کنترل توزیع شده؛ FCS، سیستم کنترل فیلدباس؛ NCS، سیستم کنترل شبکه؛ ما: میزان استفاده از اکسیژن؛ CER، CO 2 نرخ انتشار کنترل PID، کنترل نسبت-انتگرال-دیفرانسیل.
شکل 1. خلاصه تحقیقات در مورد سیستم های کنترل بیوراکتور. S، سنسورهای عملکردی خاص؛ O، سنسورهای نوری؛ آشکارسازهای آنلاین مبتنی بر ام اس. B، بیوسنسورها؛ DO، اکسیژن محلول؛ ORP، پتانسیل کاهش اکسیداسیون؛ PLC، کنترل کننده منطقی قابل برنامه ریزی؛ DCS، سیستم کنترل توزیع شده؛ FCS، سیستم کنترل فیلدباس؛ NCS، سیستم کنترل شبکه؛ ما: میزان استفاده از اکسیژن؛ CER، CO 2 نرخ انتشار کنترل PID، کنترل نسبت-انتگرال-دیفرانسیل.
در اینجا، ما بحث خود را بر روی توسعه سیستمهای کنترل بیوراکتور جدید مبتنی بر حسگرها و محرکهای هوشمند توزیعشده موازی متمرکز میکنیم که مرتبه پایینتری از سلسله مراتب و بازده کنترل بالاتری دارند. توابع رایانههای صحرایی صنعتی در HSCS کلاسیک به حسگرهای هوشمند، محرکها و پایانههای سیار رایانههای لایه بالایی در این سیستمهای کنترل جدید توزیع شدهاند. پیشرفت سریع در توسعه حسگرهای هوشمند جدید، مهندسی مکانیک، و فناوری اطلاعات و ارتباطات این پتانسیل را دارد که این سیستمهای کنترل بیوراکتور جدید را کارآمدتر، قویتر و اقتصادیتر کند.
تکامل ساختار فیزیکی سیستم های کنترل بیوراکتور
سیستم های کنترل ساختار سلسله مراتبی کلاسیک
کنترل اولیه بیوراکتور به عملکرد انسانی بر اساس دانش کارگران و تجربه عملی طولانی مدت وابسته بود. با توسعه فناوری حسگر، که امکان نظارت بر روی پارامترهای فرآیند مختلف و استفاده از رایانههای دیجیتال و محرکها را فراهم میکند، نظارت و کنترل فرآیند بیورآکتورها به عصر اتوماسیون قدم گذاشته است ( Stanke and Hitzmann, 2013 ; Lemoine et al. ، 2017 ؛ Bockisch و همکاران، 2019 ). به طور همزمان، HSCS برای بیوراکتورها پس از چندین دهه کاربرد عملی پدید آمد و تکامل یافت ( Rolf et al., 1982 ). از منظر فنی، HSCS برای بیوراکتورها در دو مرحله، مرحله PLC و مرحله DCS توسعه یافت.
یک بیوراکتور کلاسیک HSCS معمولاً شامل سه لایه است ( شکل 2 ). لایه پایینی شامل دستگاه های نظارت و کنترل پارامترهای فرآیند است ( رولف و همکاران، 1982 ؛ استانک و هیتزمن، 2013 ). در بیوراکتورهای تخمیر، پارامترهای فرآیند معمولاً شامل پارامترهای فیزیکی، شیمیایی، فیزیولوژیکی و بیوشیمیایی میشوند. برای برخی از پارامترهای فیزیکی و شیمیایی مانند دما، pH، سرعت چرخش، DO، فشار، سطح مایع، OD و ویسکوزیته، سنسورهای عملکردی خاصی ایجاد شدهاند و کنترل این پارامترهای فرآیند را میتوان از طریق استراتژیهای کنترل کلاسیک بر اساس خاص انجام داد. محرک ها ( رودریگز-دوران و همکاران، 2001 ). برای پارامترهای فیزیولوژیکی و بیوشیمیایی مانند زیست توده، غلظتهای کلیدی مواد مغذی و متابولیتها، و ترکیب گاز، امکانات نظارتی پیچیدهتر، و همچنین استراتژیها و الگوریتمهای کنترل پیشرفته، معمولاً اتخاذ میشوند ( Lemoine et al., 2017 ; Bockisch et al., 2019 ) . لایه میانی یک بیوراکتور HSCS از کامپیوترهای میدان صنعتی، مانند سیستم های اولیه PLC با یک ماژول ریزپردازنده تشکیل شده است. عملکرد لایه میانی شامل دریافت سیگنالهای مشابه از حسگرها و تبدیل آنها به سیگنالهای دیجیتال (در برخی کاربردها)، ثبت دادههای فرآیند، تنظیم پارامترهای فرآیند، اجرای الگوریتمهای بهینهسازی برای کنترل پارامترها، تولید دستورات تحریک برای محرکها، ارائه فرآیند است. داده ها و ارتباط با کامپیوترهای لایه بالایی یا سایر سیستم های PLC. کامپیوتر میدان صنعتی لایه میانی به عنوان پلی برای ارتباطات دوطرفه داده در HSCS برای بیوراکتورها عمل کرده است. لایه بالایی یک بیوراکتور HSCS از رایانه های مرکزی مانند رایانه رومیزی تشکیل شده است. کارکردهای اصلی رایانه های مرکزی لایه بالایی شامل به دست آوردن داده های فرآیند از رایانه های میدان صنعتی و مدیریت داده ها (به عنوان مثال، تجسم داده های پارامتر فرآیند برای مدیریت زمان واقعی و مقایسه و تجزیه و تحلیل داده های تاریخی آزمایش های ثبت شده برای ارزیابی و توسعه فرآیند) است. . کامپیوتر مرکزی لایه بالایی بالاترین ترمینال یک واحد عملیاتی یک سیستم کنترل بیوراکتور است، اما بسیاری از کامپیوترهای مرکزی لایه بالایی را می توان از طریق یک شبکه محلی متصل کرد تا یک سیستم کنترل بزرگتر مانند سیستم کنترل DCS برای نیروگاه های بزرگ تشکیل دهد. تعداد واحدهای بیوراکتور
HSCS کلاسیک برای بیوراکتورها نشان دهنده پیشرفت فوق العاده ای در مقایسه با کنترل توزیع شده قبلی و مدیریت توزیع شده است و در بیوراکتورهای تجاری در مقیاس ها و پیچیدگی های مختلف استفاده شده است. سطح پایه معمولاً شامل رایانههای شخصی مجهز به سیستمعامل کاربر پسند و در دسترس تجاری (مثلاً LabView) یا بستههای نرمافزاری ارائهشده توسط تأمینکننده بیوراکتور برای کنترل بیوراکتورهای رومیزی است. این ترتیب یک پلت فرم بسیار انعطاف پذیر برای سیستم های DIY و اکتشاف دستگاه های تحلیلی و کنترلی جدید فراهم می کند. سطح میانی یک سیستم بسیار یکپارچه تر است که معمولاً PLC ها، رابط ماشین انسانی (مانند صفحه لمسی) و یک ماژول ضبط داده را در خود جای می دهد. در اصل، سیستم های تخمیر ارائه شده توسط تامین کنندگان اصلی فعلی (به عنوان مثال، Biostat، BioFlo، Minifors، و Biobundle) همه را می توان در این دسته گروه بندی کرد. سطح پیشرفته عمدتاً در کارخانههای آزمایشی و تأسیسات تولید (به عنوان مثال، Eli Lilly و شرکت) استفاده شده است، که معمولاً DCS را اتخاذ میکنند و همچنین ممکن است با یک سیستم PAT، مدیریت دادههای پیشرفته و MES برای نظارت و کنترل فرآیند ادغام شوند. آلفورد، 2006 ).
با این حال، اشکالات ذاتی در HSCS کلاسیک برای بیوراکتورها در مقایسه با FOCS جدید توسعه یافته نیز وجود دارد ( جدول 1 ). در مرحله اول، سیگنالهای پارامتر از حسگرهای مختلف به طور جداگانه به رایانههای میدان صنعتی لایه میانی و دستورات فعالسازی از رایانههای لایه میانی به محرکها نقطه به نقطه برای کنترل پارامتر فرآیند ارسال شد، به طوری که سیمکشی و شبکههای ارتباطی گسترده مورد نیاز بود. ثانیا، دستگاه های تولید کنندگان مختلف را نمی توان به راحتی تعویض کرد. ثالثاً، از منظر عملکردی، توابع جمعآوری، ارائه و تجزیه و تحلیل دادههای رایانههای مرکزی لایه بالایی تا حد زیادی با رایانههای میدان صنعتی لایه میانی همپوشانی دارند، به ویژه با پیشرفت سریع در ظرفیت محاسباتی ریزپردازندهها و ظرفیت ذخیرهسازی. از تراشه های فلش در نهایت، توسعه سریع دستگاههای هوشمند یکپارچهسازی پردازش سیگنال و محاسبات توسط حسگرهای هوشمند را امکانپذیر کرد ( Mora-Mora et al., 2015 ؛ Shabha and Conway, 2016). ; وانگ و همکاران، 2017 ; لوئیس و همکاران، 2018 ). سیستمهای کنترل جدید بیوراکتورها که ممکن است از این اشکالات جلوگیری کنند بسیار امیدوارکننده هستند.
 جدول 1. خلاصه مشخصات اصلی انواع مختلف سیستم های کنترل برای بیوراکتورها.
جدول 1. خلاصه مشخصات اصلی انواع مختلف سیستم های کنترل برای بیوراکتورها.
سیستم کنترل فیلدباس
برای غلبه بر معایب HSCS کلاسیک برای بیوراکتورها، محققان استراتژیهای جدیدی را برای ساختن سیستمهای کنترل کارآمد و قوی ایجاد کردند. FCS، که به طور گسترده در بسیاری از فرآیندهای تولید به کار گرفته شده است، اولین گام به سمت یک FOCS جدید برای بیوراکتورها است ( Leite et al., 2010 ; Van Loon, 2015 ). FCS در اینجا به عنوان جایگزینی برای HSCS کلاسیک برای بیوراکتورها مورد بحث قرار می گیرد.
مهمترین ویژگی طراحی FCS ادغام کانال های انتقال سیگنال نقطه به نقطه به طور جداگانه بین دستگاه های میدانی و کنترلرها در یک کانال ارتباطی مشترک است و در بیشتر مواقع سیگنال های دیجیتال به جای سیگنال های آنالوگ در FCS منتقل می شوند. با توجه به استانداردهای ارتباطی خاص تمام دستگاه های میدانی از طریق یک فیلدباس در FCS به رایانه مرکزی متصل شده اند ( ورهاپن، 2009 ). FCS اولین گام را به سوی توسعه یک FOCS جدید برای بیوراکتورها برداشته است. از طریق طرح مذکور، عملکردهای نظارت و تحریک پارامتر فرآیند، پردازش سیگنال، جمعآوری دادهها و ارائه متعلق به لایههای مختلف HSCS کلاسیک بین حسگرها/عملگرها، واحدهای پردازش سیگنال و واحدهای محاسباتی FOCS جدید توزیع شده است. بیوراکتورها طرحی از FOCS جدید برای بیوراکتورها بر اساس حسگرها/عملگرهای هوشمند متصل به کامپیوترهای مرکزی از طریق ارتباط بی سیم در شکل 3 .
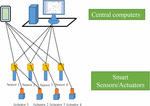 شکل 3. ساختار یک سیستم جدید کنترل سازمانی مسطح برای بیوراکتورها.
شکل 3. ساختار یک سیستم جدید کنترل سازمانی مسطح برای بیوراکتورها.
معماری فیزیکی FCS را می توان به دو لایه تقسیم کرد، اولین لایه شامل دستگاه های میدانی مانند حسگرها، محرک ها و کانال ارتباطی (فیلدباس) و لایه دوم شامل رایانه مرکزی و اتصالات گسترده آن است ( ورهاپن، 2009 ). لایه 1 یک FCS پیشرفته متشکل از حسگرها و محرک های هوشمند قابل همکاری است. سنسور هوشمند یک سیستم سنجش پیشرفته است که یک عنصر حسگر را با پردازش سیگنال حسگر و قابلیت های محاسباتی داده ارائه شده توسط یک ریزپردازنده و اجزای مرتبط ترکیب می کند ( گری و همکاران، 2010 ). بر این اساس، یک محرک هوشمند به عنوان یک دستگاه محرک پیشرفته نامیده میشود که عنصر محرک را با یک ریزپردازنده و اجزای مرتبط ترکیب میکند که ارتباطات سیگنال تحریک، محاسبات، تشخیص وضعیت و عملکردهای گزارش را ارائه میکند. این دستگاههای هوشمند دارای درجا ، خود تشخیصی، تصحیح و ثبت سابقه عملیات هستند که ممکن است یکپارچگی سیستمهای کنترل را افزایش دهد، ممکن است زمان صرف شده برای تشخیص شکست فرآیند را کاهش دهد و میتواند به طور گسترده در تنظیم و کنترل فرآیندهای زیستی استفاده شود. حسگرها و محرکهای هوشمند یک کنترل حلقه بسته از پارامترها را با توجه به تنظیمات FCS از طریق جفتهای حسگر-محرک تشکیل میدهند. برای کنترل پارامترهای پیچیده تر، سنسورهای هوشمند ممکن است با بیش از یک محرک ارتباط برقرار کنند. علاوه بر کنترل حلقه بسته پارامترهای فرآیند خاص، حسگرها و محرکهای هوشمند همچنین میتوانند تنظیمات پارامتر را از رایانههای مرکزی دریافت کرده و دادههای فرآیند را به آنها گزارش دهند.
کانال ارتباطی مشترک
در هر بخش از یک FCS وظیفه انتقال دو طرفه سیگنال های دیجیتال بین دستگاه های میدانی و رایانه های مرکزی را دارد. در طول دهههای گذشته توسعه FCS، بیش از هشت استاندارد ارتباطی توسط سازمانهای تجاری مختلف برای ارتباط مؤثر بین دستگاههای تامینکنندگان مختلف توسعه داده شده است [Foundation Fieldbus (H-1); کنترل شبکه؛ Profibus – DP، PA، و FMS؛ P-Net; HSE (اترنت پرسرعت) H-2; سوئیفت نت؛ WorldFIP; Interbus-S] ( ورهاپن، 2009 ). با توسعه سریع فناوری ارتباطات سیار، ارتباطات بی سیم برای برنامه های کاربردی FCS نیز به کار گرفته شده است ( Zhu et al., 2012 ). لایه 2 یک FCS از رایانه های مرکزی تشکیل شده است و شبیه رایانه های لایه بالایی HSCS کلاسیک برای بیوراکتورها است. رایانههای مرکزی یک FCS بهجای دریافت دادههای فرآیند از رایانههای میدان صنعتی سطح متوسط، دادههای فرآیند را مستقیماً از طریق کانال ارتباطی فیلدباس با حسگرهای هوشمند ارتباط برقرار میکنند. به عبارت دیگر، رایانه میدان میانی در FCS حذف شده است. دادههای حسگرها و محرکهای هوشمند لایه 1 که توسط رایانههای مرکزی به دست میآیند (از طریق کارت میزبان H 1 در مورد سیستم کنترل پایه فیلدباس) را میتوان به اشکال مختلف ارائه کرد و برای نمایش پارامترهای مرتبه بالاتر برای ارزیابی فرآیند پردازش کرد. پایانه های سیار کامپیوتر مرکزی نیز برای پیکربندی راحت پارامترهای فرآیند و نظارت بر وضعیت بیوراکتورها در کارخانه های تولید در دسترس هستند.
از آنجا که انتقال سیگنال نقطه به نقطه در HSCS کلاسیک برای بیوراکتورها با کانال های ارتباطی فیلدباس در FCS جایگزین شده است، ایمنی و قابلیت اطمینان کانال های ارتباطی فیلدباس به موضوعاتی حیاتی در توسعه FCS تبدیل شده است. استراتژیهای زیادی برای برآورده کردن خواستههای ناشی از پیادهسازیهای خاص ایجاد شدهاند ( ژونگ و چن، 2015 ؛ Julsereewong و همکاران، 2018 ). مقاله ای توسط ژونگ و چن (2015) یک روش موثر برای ادغام دستگاه های فیلدباس مختلف در یک سیستم کنترلی را گزارش کرد که مشکل پایداری FCS های بزرگ را حل کرد. در کارهای جدیدتر، Julsereewong و همکاران. (2018) یک تجزیه و تحلیل مقایسه ای از مشکل ایمنی “کنترل در میزبان” و “کنترل در میدان” در سیستم کنترل پایه فیلدباس (FF) انجام داد که می تواند به عنوان یک ابزار ارزیابی برای مرحله طراحی FF- استفاده شود. حلقه های کنترل مبتنی بر این مطالعات مرتبط ایمنی و پایداری FCS را تا حد زیادی بهبود بخشید.
FCSs قبلاً در چندین مطالعه با موفقیت در کنترل بیوراکتور استفاده شده است. Wu و همکارانش با موفقیت یک FCS را برای کنترل فرآیند L- asparaginase II به کار گرفتند که خروجی را 100% در مقایسه با روش های کنترل مرسوم افزایش داد ( Xiaopeng and Baoguo, 2006 ). علاوه بر فرآیندهای تخمیر، یک FCS نیز با موفقیت در کنترل فرآیند گیاهان بازیابی آنزیمی برای ارزیابی کنترلکنندههای هوشمند مختلف اجرا شده است و نتایج تجربی اثربخشی بیشتر کنترلکنندههای فازی را در مقایسه با کنترل پیشبینی عصبی تأیید میکند. علاوه بر این، کنترل کننده PI فازی خطای کمتر، مصرف انرژی کمتر و بازیابی بهتر فعالیت آنزیم را نشان داد ( Leite et al., 2010 ). ون لون (2015) گزارش داد که استفاده از FCS هوشمند به جای خطوط هوای فشرده در کابینت های کنترلی تولیدکننده نوشیدنی Teisseire باعث افزایش قابلیت اطمینان و کارایی خط تولید آن شد.
سیستم کنترل شبکه ای
NCS شکل دیگری از FOCS است که می تواند برای کنترل بیوراکتور استفاده شود. درست پس از ظهور FCS ها در دهه 1990، مفهوم اتصال همه دستگاه های میدانی به یک شبکه و استفاده از اینترنت در دسترس برای انتقال داده به جای سیستم های فیلدباس ویژه محدود به استانداردهای ارتباطی خاص قبلا مطرح شده بود. بررسی NCS ها از زمان ظهور آنها موضوع بسیار داغ بوده است و بررسی های مفصل زیادی این زمینه را پوشش داده است ( گوپتا و چاو، 2010 ؛ محمود و IEEE، 2014 ؛ ماری و همکاران، 2016 ). در اینجا، ما فقط یک بحث مختصر در مورد این موضوع و کاربردهای پیشنهادی آن در آینده در کنترل بیوراکتور اضافه کردیم.
در حالی که معماری فیزیکی یک NCS به طور کلی مشابه است، یک تفاوت اساسی با یک FCS دارد: ساختار سلسله مراتبی با یک ساختار کاملاً توزیع شده جایگزین شده است، به طوری که هر دستگاه در این زمینه به یک گره عملکردی در شبکه تبدیل شده است ( ماری و همکاران .، 2016 ). از نظر تئوری، همه دستگاههای موجود در شبکه NCS میتوانند تحت برنامههای زمانی مشخص با یکدیگر ارتباط برقرار کنند. در NCS کلاسیک، سیگنالهای پارامتر فرآیند توسط حسگرها به سیگنالهای دیجیتال تبدیل میشوند و به کنترلکنندهها ارسال میشوند، پس از آن دستورالعملهای عمل از کنترلکنندهها به محرکها ارسال میشوند و حلقه کنترل بازخورد از طریق شبکه پیادهسازی میشود. این معماری NCS باعث شده است که داده های سیستم کنترل میدانی به راحتی از مکان های دوردست قابل دسترسی باشد و جزیره اطلاعات دستگاه های میدانی خاص و حتی شبکه های کنترلی خاص را حذف کند. استفاده از اینترنت برای ارتباطات داده در سیستم کنترل میدانی دارای مزایای سرعت بالا، دسترسی راحت و قابلیت همکاری دستگاه ها است و همچنین امکان اجرای استراتژی های کنترلی پیچیده تری را فراهم می کند. مری و همکاران، 2016 ).
NCS
در زمینه های مختلفی از جمله کشاورزی دقیق، تولید پیشرفته، انرژی و حمل و نقل معرفی شده است. در کشاورزی دقیق، NCS برای تثبیت محیط مصنوعی گلخانه ها و کنترل سیستم های کانال آبیاری استفاده شده است ( لای و همکاران، 2015 ؛ ابراهیم و همکاران، 2018 ). NCS همچنین به طور گسترده در تولید پیشرفته، از جمله کنترل کارخانه های مکانیکی استفاده شده است ( Cuenca et al., 2018 ). کاربرد تثبیت کننده های سیستم قدرت مبتنی بر NCS در شبکه های قدرت نیز توسط Zhang و همکاران گزارش شده است. (2014) . در زمینه حمل و نقل، NCS برای کنترل وسایل نقلیه و مدیریت ایمنی ترافیک بزرگراه استفاده شده است ( Bao et al., 2017 ; Latrech et al., 2018 ). با این حال، استفاده از NCS برای کنترل بیوراکتور هنوز در افق است و مقالات کمی به این موضوع پرداختهاند. از آنجایی که تخمیرها همیشه فرآیندهای چند پارامتری پیچیده و حساس هستند، کنترل دقیق و خودکار پارامترهای فرآیند بسیار مهم است، که نشان میدهد استفاده از NCS برای کنترل بیوراکتور بسیار امیدوارکننده خواهد بود.
در NCS، ادغام یک شبکه در حلقه کنترل بازخورد چالشهای جدیدی را به همراه داشته است که در سیستمهای کنترل سنتی با آن مواجه نبودند. مسائل مهم برای NCS شامل تأخیرهای ارتباطی، کیفیت کنترل، ثبات و ایمنی است ( Sakthivel و همکاران، 2015 ؛ Li Z. و همکاران، 2016 ؛ Hu et al.، 2017 ؛ Yaseen and Bayart، 2018 ). برای کاهش عوارض جانبی مضر شبکه NCS، دو خط مطالعه بر روی اصول “کنترل شبکه” و “کنترل بر شبکه” متمرکز شده است ( گوپتا و چاو، 2010 ). جهت “کنترل شبکه” بر بررسی فناوری شبکه برای انتقال داده ها متمرکز است (به عنوان مثال، یک شبکه ارتباطی بی سیم)، در حالی که جهت “کنترل روی شبکه” شامل مطالعات مربوط به تاخیر شبکه و افت بسته، تخصیص پهنای باند و زمان بندی است. امنیت شبکه، کنترل مقاوم در برابر خطا، و ادغام اجزا با سیستم عامل و رابط مناسب ( گوپتا و چاو، 2010 ). در یک مطالعه، مدلسازی و تحلیل تاخیر شبکه انجام شد و روشهای جبران تاخیر برای مقابله با این مشکل توسعه یافت. کوزو و همکاران، 2016 ). پیشرفت قابل توجهی در افزایش پایداری و ایمنی NCS نیز در چندین مطالعه به دست آمده است. Bouazza و همکارانش از یک کنترلکننده بازخورد خروجی پویا برای بهبود پایداری یک کلاس از NCS زمان گسسته غیرخطی استفاده کردند، در حالی که گروه دیگری به رهبری لی یک رویکرد جدید تقسیمبندی تاخیری را اتخاذ کردند که امکان در نظر گرفتن کامل اطلاعات در هر دو محدوده را فراهم میکرد. تأخیرهای ناشی از شبکه و حداکثر تعداد حذف متوالی بسته داده، که در نهایت منجر به بهبود پایداری NCS شد ( Bouazza، 2015 ؛ Li Z. و همکاران، 2016 ). هو و همکاران (2017) به تثبیت میانگین مربعات برای NCS در صورت حمله سایبری DoS پرداخت. قوانین سوئیچینگ حداقل و همچنین روش هایی برای محاسبه کنترل کننده های بازخورد حالت برای مقابله با این مشکل پیشنهاد شده است. از آنجایی که پایداری و ایمنی سیستمهای کنترل بیوراکتور یکی از اهداف حیاتی مهندسی فرآیندهای زیستی است، این مطالعات در مورد پایداری و ایمنی NCS، اجرای NCSs در کنترل بیوراکتور را بیشتر ترویج میکند.
FOCS
برای بیوراکتورها، مانند FCS و NCS در حال افزایش، مزایای مهم زیادی را نسبت به HSCS کلاسیک برای بیوراکتورها نشان می دهد ( جدول 1 ). اول از همه، FCS و NCS دارای ساختار فیزیکی دو لایه یا ساختار مسطح کاملاً توزیع شده هستند، که ساده تر از ساختار سه لایه HSCS های بیوراکتور کلاسیک است. در نتیجه، پارامترهای فرآیندی که توسط سنسورهای مختلف نظارت میشوند را میتوان در محل و سفارشها مستقیماً به محرکهای جفت ارسال میشوند. کاهش تعداد لایه ها در FOCS و استفاده از سیستم ها یا شبکه های فیلدباس، پیچیدگی سیم کشی و بار ارتباطی بین لایه های مختلف را کاهش داده است. علاوه بر این، اختلال در عملکرد یک سنسور هوشمند با سیگنالهای پارامترهای فرآیند دیگر تداخل ندارد، که باعث میشود تشخیص خطاهای فرآیند راحتتر از HSCS برای بیوراکتورها باشد. حسگرها و محرکهای هوشمند از تولیدکنندگان مختلف که با همان فیلدباس و استانداردهای ارتباط شبکه سازگار هستند نیز قابل تعویض هستند که ممکن است هزینههای نگهداری را کاهش دهد. علاوه بر این، استفاده از پایانههای سیار متصل به رایانه مرکزی به جای صفحهکلیدهای لمسی و صفحهکلید زیاد روی رایانههای صنعتی در کارخانه نیز ممکن است کل سرمایهگذاری را کاهش دهد. محققان همچنین رقابت اقتصادی FCS را در مقایسه با HSCS کلاسیک برای بیوراکتورها آشکار کرده اند. رضابک، 2001 ).
سیستم کنترل مبتنی بر دانش
با توسعه ظرفیت نظارت بر فرآیند از طریق استفاده از حسگرهای جدید و PAT آنلاین/خارج از خط، ادغام چندین مجموعه داده فرآیند آنلاین و آفلاین در یک سیستم کنترل زمان واقعی به یک چالش بزرگ در توسعه بیوراکتور تبدیل شده است. سیستمهای کنترل. با این حال، توسعه FOCS تا حدی مشکل را حل کرده است. علاوه بر این، مقادیر بسیار زیادی از دادههای فرآیندهای زیستی تاریخی در صنعت زیستی انباشته شدهاند و استفاده موفق از این منبع دیجیتال نیازمند سیستمهای کنترل هوشمندتر است. KBCS ها در طول دهه گذشته با هدف حل این مشکل پدید آمده و رشد کرده اند (راثور و همکاران، 2017 ؛ بورچرت و همکاران، 2019 ؛ استاینواندتر و هرویگ، 2019 ؛ استاینواندتر و همکاران، 2019 ). KBCS در دو سطح اجرا شده است. سطح اولیه مستلزم کنترل مستقیم یک پارامتر فرآیند خاص از طریق منطق فازی است که به عنوان کنترل فازی نیز شناخته می شود ( Wang et al., 2018 ). سطح بالاتر پیاده سازی مستلزم یک سیستم کنترل نظارتی مبتنی بر دانش است که شامل چندین ماژول است. شکل 4 ) ( کوهوت و همکاران، 2015 ). اولین ماژول اصلی پایگاه دانش است که بر اساس نتایج همبستگی های دقیق فیزیولوژی میکروبی و اندازه گیری های بیوشیمیایی، از جمله دانش کارشناسان و اپراتورهای فرآیندهای زیستی ساخته شده است. قواعد زبانی به دست آمده سپس به دستورالعمل های قابل خواندن توسط کامپیوتر تبدیل می شوند. این قوانین در پایگاه دانش سیستم کنترل ذخیره می شوند. ماژول دوم پایگاه داده است که انواع مختلفی از داده ها را در بر می گیرد، از جمله داده های فیزیکی، شیمیایی و فیزیولوژیکی میکروب ها در داخل تخمیر و وضعیت دستگاه های نظارت و تحریک فرآیند، و همچنین داده های تاریخی فرآیندهای زیستی قبلی. ماژول سوم موتور استنتاج است که به عنوان واحد محاسبات منطقی برای ارزیابی کیفیت داده های فرآیند، تشخیص وضعیت تسهیلات، پیش بینی وضعیت فیزیولوژیکی، استراتژی کنترل و خروجی پیام نشانه عمل می کند ( کوهوت و همکاران، 2015 ). در طول توسعه KBCS، استراتژیهای کنترل کلاسیک مانند PID و کنترل مبتنی بر مدل نیز با کنترل فازی برای دستیابی به عملکرد کنترل بهتر ترکیب شدهاند. تا به امروز، بسیاری از مطالعات کاربردهای موفق KBCS را نشان داده اند.
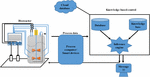 شکل 4. ساختار یک سیستم کنترل مبتنی بر دانش برای بیوراکتورها.
شکل 4. ساختار یک سیستم کنترل مبتنی بر دانش برای بیوراکتورها.
در حال حاضر
کاربردهای زیادی از KBCS در کنترل فرآیندهای زیستی وجود دارد. تعداد زیادی از کاربردهای کنترل فازی در تصفیه فاضلاب گزارش شده است. به عنوان مثال، وانگ و همکاران. (2018) طراحی یک کنترل کننده فازی چند متغیره را برای حل مشکل کنترل تخمیر ضایعات گیاهی گزارش کرد. آنها یک ماتریس ساختاری از منطق فازی ساختند تا منطق فازی پیچیده را به یک عملیات ماتریسی سادهتر تبدیل کنند، و همچنین الگوریتم جدیدی را بر اساس روش کمترین درجه برای حل مشکل قوانین کنترل ناقص و ناسازگار اتخاذ کردند. همچنین گزارش هایی از کاربردهای موفق سیستم های کنترل نظارتی مبتنی بر دانش در سطح بالاتر وجود دارد. کوهوت و همکاران (2015) از کنترل مبتنی بر دانش در تخمیر آنتی بیوتیکی استفاده کرد. در این کار، یک سیستم پشتیبانی تصمیم بر اساس دانش قبلی از فرآیند برای حمایت از اقدامات انجام شده توسط اپراتورهای فرآیند توسعه داده شد که باعث بهبود در تولید آنتیبیوتیک و کاهش تنوع فرآیند شد. بیرله و همکاران (2016) استفاده از یک سیستم خبره هوشمند مبتنی بر نظریه منطق فازی را برای کنترل فرآیند تخمیر مخمر گزارش کرد. در این کار، آنها قوانین منفی را برای تقلید از فرآیند تصمیم گیری انسانی وارد پایگاه دانش کردند. ادغام قوانین منفی منجر به کنترل بسیار پایدارتر و دقیق تر فرآیند در مقایسه با کنترل کننده با استفاده از قوانین مثبت شد. علاوه بر این، کاربرد KBCS تنها به کنترل فرآیند محدود نشده است. همراه با روش های مبتنی بر مدل، کرول و همکاران. (2017) و Rajamanickam و همکاران. (2017) کاربرد KBCS در DOE برای توسعه فرآیندهای زیستی را گزارش کرد. از منظری گسترده تر، مفهوم کنترل فرآیندهای زیستی و عملکردهای سیستم های کنترل بیوراکتور به کنترل کیفیت و مدیریت داده ها در کل چرخه عمر تولید بسط داده شده است. برای حل مشکلات تنگنا در صنعت بیوتکنولوژی، مانند نیازهای طولانی مدت و سرمایه گذاری سرمایه توسعه محصول جدید، اثرات کاهش مقیاس و افزایش مقیاس فرآیندهای زیستی، کمبود کارگران ماهر، و دانش ناقص در مورد وضعیت بلادرنگ Steinwandter و Herwig در یک فرآیند تولید، ادغام ایدهها و روشهایی از علم داده در کنترل فرآیندهای زیستی را گزارش کردند که توسعه و استفاده از KBCS را بیشتر تحریک میکند. Steinwandter و همکاران، 2019 ; Steinwandter و Herwig، 2019 ).
KBCS برای بیوراکتورها هنوز راه درازی برای انجام کامل عملکرد پیش بینی شده خود در پیش دارند، زیرا بسیاری از مشکلات حیاتی هنوز حل نشده اند. اثربخشی یک KBCS به کیفیت پایگاه داده دانش بستگی دارد. با این حال، به نظر می رسد استاندارد طلایی برای ساخت چنین پایگاه های داده وجود ندارد. عملکرد KBCS از ارائه دهندگان مختلف ممکن است متفاوت باشد و هنوز ارزیابی عینی آن دشوار است. به دلیل پیچیدگی فرآیندهای زیستی مختلف، پایگاه داده دانش بهینه برای یک گیاه/فرآیند زیستی ممکن است برای گیاه/فرآیند زیستی دیگر قابل اجرا نباشد و مجموعه قوانین خاصی باید برای هر فرآیند زیستی خاص ایجاد شود. چالش دیگر ناشی از موتور استنتاج است که باید به سرعت تکامل یابد تا بتواند با نیازهای محاسباتی رو به رشد کنترل فرآیند بلادرنگ مطابقت داشته باشد. توسعه هوش مصنوعی، یادگیری ماشین و بیوشیمی فرآیند، و همچنین مطالعات بیشتر در مورد فیزیولوژی میکروارگانیسمهای مورد استفاده، منجر به استراتژیهای جدیدی برای حل این مشکلات و تقویت دامنه و اثربخشی KBCS برای بیوراکتورها خواهد شد.
کاربرد سنسورها و محرک های هوشمند در سیستم های کنترل بیوراکتور جدید
توسعه حسگرهای جدید و PATهای پیشرفته به عنوان پایه سنسورهای هوشمند
حسگرها در سیستم های کنترلی فوق الذکر برای بیوراکتورها نقش های ضروری ایفا کرده اند. اگرچه اکثر پارامترهای فرآیند فیزیکی و شیمیایی را می توان مستقیماً با حسگرهای عملکردی خاص پایش کرد، هنوز برخی از پارامترهای فرآیند، به ویژه آنهایی که مربوط به ویژگی های فیزیولوژیکی و بیوشیمیایی کشت ها هستند، وجود دارند که به راحتی قابل اندازه گیری نیستند. حسگرهای جدید مختلف و PATهای پیشرفته به عنوان پایه حسگرهای هوشمند توسعه یافته اند، همانطور که در برخی از بررسی های عالی مورد بحث قرار گرفته است ( Randek and Mandenius، 2018 ؛ Bockisch et al., 2019 ). در این میان، مطالعات روی حسگرهای نوری و تکنیک های تحلیل طیف شناسی توجه زیادی را به خود جلب کرده است. از آنجایی که مورفولوژی سلولی یک فنوتیپ فیزیولوژیکی مهم از کشت ها است که ممکن است تأثیر مهمی بر محصولات نهایی داشته باشد، حسگرها و PAT های زیادی برای نظارت بر این پارامترهای فرآیند توسعه یافته اند ( Lemoine et al., 2017 ). در یک مطالعه، Kuystermans و همکاران. (2016) استفاده از روشهای مبتنی بر فلوسیتومتری را برای نظارت بر مراحل مختلف آپوپتوز کشتهای سلولی پستانداران در طول فرآیند تولید گزارش کرد. روشهای مبتنی بر فلوسایتومتری نیز برای مطالعه مورفولوژی و زنده ماندن قارچ رشتهای استفاده شده است. پنی سیلیوم کریزوژنوم و ناهمگونی جمعیت در پاسخ به تغییرات در دسترس بودن سوبسترا در اشریشیا کلی و ساکارومایسس سرویزیه ( Heins et al., 2019 ؛ Veiter and Herwig, 2019 ). درجا یکی دیگر از ابزارهای موثر برای مطالعه ناهمگونی جمعیت است. در یک مطالعه، Marba-Ardebol و همکاران. (2018) پایش بلادرنگ شاخص جوانه زدن در S. cerevisiae کشت های دسته ای درجا میکروسکوپ ناهمگونی جمعیت ناشی از شرایط کشت ناهمگن یک پدیده رایج در بسیاری از فرآیندهای زیستی است، و این ناهمگنی نه تنها در مورفولوژی سلولی منعکس میشود، بلکه شامل تفاوتهایی در غلظتهای درون سلولی واسطههای متابولیک مهم میشود ( Heins and Weuster-Botz, 2018 ). نظارت بر متابولیت های مهم مانند لیپیدها، پروتئین ها و نشاسته در داخل سلول ها یک نیاز فوری در توسعه فرآیندهای زیستی و تولید در مقیاس بزرگ است. مورشت و همکاران (2016) یک سنجش خودکار رنگآمیزی قرمز نیل را توسعه داد که کمیت بازده بالا تولید لیپید میکروجلبک را برای توسعه فرآیندهای زیستی امکانپذیر کرد. چندین گروه همچنین اجرای طیفسنجی غیرتهاجمی رامان را برای نظارت بر تولید mAb و لیپید در طول توسعه فرآیندهای زیستی گزارش کردند. او و همکاران، 2017 ; سانتوس و همکاران، 2019 ). طیفسنجی غیرتهاجمی رامان نیز برای نظارت بر پارامترهای مهم مانند غلظت گلوکز در بیوراکتور برای کنترل بازخورد استفاده شده است ( رولند جونز و ژاک، 2018 ؛ هیرش و همکاران، 2019 ).
حسگرهای مبتنی بر طیفسنجی فلورسانس
به طور گسترده برای کاربردهای مختلف در نظارت بر فرآیندهای زیستی استفاده میشوند و برخی بررسیهای دقیق این موضوع را پوشش دادهاند ( فاسن و هیتزمن، 2015 ). در یک مطالعه، Janzen و همکاران. (2015) دو حسگر PH فلورمتری جدید را برای نظارت بر فرآیندهای زیستی در pH پایین ارزیابی کرد که دامنه کاری سنسورهای pH فلورمتری قبلی را افزایش داد. لدنر و همکاران (2016) و اسواجاروان و همکاران. (2017) کاربرد یکپارچه طیفسنجی فلورسانس را با سیستم کشت صفحه میکروتیتر و توسعه تکنیکهای طیفسنجی فلورسانس چند طول موجی (2D) برای نظارت بر فرآیندهای زیستی گزارش کرد. علاوه بر این، بسیاری از سنسورهای نوری مختلف و تکنیکهای تحلیلی مبتنی بر نور مرئی (به عنوان مثال، حسگرهای RGB)، نور UV، یا طیفهای NIR، رامان یا پالسی تراهرتز نیز برای نظارت بر پارامترهای بیوشیمیایی آبگوشت تخمیر توسعه داده شدهاند. Classen و همکاران، 2017 ; Bockisch و همکاران، 2019 ). این حسگرها و PATهای جدید را میتوان به حسگرهای هوشمند برای کاربرد در سیستمهای کنترل بیوراکتور نسل جدید توسعه داد.
توسعه روشهای نمونهگیری پیشرفته برای اندازهگیری آنلاین پارامترهای فرآیند که در حال حاضر با استفاده از حسگرهای آنلاین قابل نظارت نیستند، یکی دیگر از روشهای مهم تحقیق در مورد کنترل فرآیندهای زیستی است. سیستم های FIA همراه با حسگرهای زیستی یک استراتژی جدید برای نظارت بر غلظت متابولیت های مهم ارائه کرده اند ( کومار، 2011 ). اخیراً، امکانات تحلیلی پیشرفته نیز با سیستمهای نمونهبرداری خودکار برای نظارت بر فرآیندهای زیستی ادغام شدهاند. در یک مطالعه، Wu و Wee (2015) یک پروتکل آماده سازی نمونه اسید آمینه خودکار را به یک سیستم μSI متصل به یک سیستم UPLC برای جداسازی و کمی سازی اسیدهای آمینه در زمان واقعی و آنلاین وارد کردند. در مطالعه اخیر دیگری، کاپوزی و همکاران. (2017) با موفقیت یک روش مبتنی بر جفت کردن یک PTR-ToF-MS، یک نمونهگیر خودکار و ابزارهای تجزیه و تحلیل دادهها را برای نظارت بر ترکیبات آلی فرار در آبگوشت تخمیر ایجاد کرد. کشت با توان بالا یک نیاز مهم برای توسعه فرآیندهای زیستی و ارزیابی کرنش است. همراه با توسعه دستگاههای نظارت بر فرآیند با توان بالا، استفاده از پلتفرمهای نمونهبرداری خودکار با توان عملیاتی بالا همراه با تکنیکهای تجزیه و تحلیل سریع، راه دیگری برای دریافت سریع دادههای پردازش زیستی است. در یک مطالعه، کروز بورنازو و همکارانش یک پلت فرم مینی بیوراکتور رباتیک یکپارچه برای کشت میکروبی موازی و خودکار با مدیریت آنلاین داده ها و کنترل فرآیند معرفی کردند. هابی و همکاران، 2019 ). از طریق این پلتفرم، آنها با موفقیت کشت با توان بالا را با تجزیه و تحلیل سریع فرآیند با توان بالا برای توسعه فرآیند ترکیب کردند. توسعه و بکارگیری آن حسگرها و PTAهای جدید، نظارت و کنترل موثری بر فرآیندهای زیستی از کشت معمولی در بیوراکتورهای منفرد گرفته تا کشت با توان بالا در چندین بیورآکتور مینیاتوری، از کشت در مقیاس میکرولیتر تا تولید زیستی در مقیاس صنعتی را ممکن کرده است. توسعه حسگرهای جدید و PATهای پیشرفته در تلاش است تا با سرعت پیش رفته و گسترش سریع کاربردهای فرآیندهای زیستی را در شرایط مختلف تسهیل کند. با پیشرفت فنی در زمینه های مختلف و تلاقی تحقیقات انضباطی متعدد، توسعه حسگرها و PAT های جدید به مرحله ادغام قابلیت پردازش هوشمند داده ها قدم گذاشته است.
ادغام پردازش سیگنال، فعال سازی، محاسبات و ارتباطات در حسگرها و محرک های هوشمند
به عنوان پایه و اساس FOCS برای بیوراکتورها، حسگرها و محرکهای هوشمند نقشهای حیاتی در نظارت بر پارامترهای فرآیند، پردازش سیگنال، درجا ، ارتباطات و اجرای دستورالعملهای فعالسازی دارند. توسعه حسگرها و محرک های هوشمند مرحله بسیار مهمی در تکامل سیستم های کنترل بیوراکتور است. معماری کلی سنسورها و محرک های هوشمند برای کاربرد در نظارت و کنترل فرآیندهای زیستی در شکل 5 نشان داده شده است (گری و همکاران، 2010 ). معماری اصلی حسگرهای هوشمند برای نظارت و کنترل فرآیندهای زیستی شامل یک واحد حسگر کلاسیک و یک واحد آداپتور است. عملکرد واحد حسگر در یک سنسور هوشمند، نظارت و تبدیل پارامترهای فرآیند به شکل سیگنالهای آنالوگ، مشابه حسگرهای سنتی است. عملکردهای مؤلفه ارتباطی و محاسباتی (واحد آداپتور) در یک سنسور هوشمند شامل تبدیل A/D و D/A سیگنالها، سنسورهای شرطیسازی و خود تشخیصی، الگوریتمهای کنترلی که توسط ریزپردازندههای داخلی اجرا میشوند، ارسال و دریافت دادهها از سایرین است. حسگرها/عملگرهای هوشمند یا کامپیوترهای مرکزی و منبع تغذیه. حسگر هوشمند بخشی از عملکرد رایانه های میدان صنعتی را در HSCS کلاسیک برای بیوراکتورها انجام می دهد. از آنجایی که وظایف محاسباتی حسگرهای هوشمند خاص معمولاً نسبت به رایانههای صنعتی صنعتی کمتر است، الزامات ظرفیت محاسباتی نیز تقاضای کمتری دارند. با توسعه سریع پلتفرمهای سختافزاری ارزانتر و کوچکتر، سیستمعاملهای کاربردی، منابع تغذیه و تکنیکهای ساخت میکرو، کاربرد سنسورهای هوشمند در زمینههای مختلف رو به افزایش است. لی و همکاران، 2015 ; ژائو و همکاران، 2016 ; پرز و همکاران، 2018 ; ژانگ و همکاران، 2018 ).
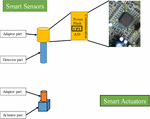 شکل 5. معماری کلی سنسور و محرک هوشمند.
شکل 5. معماری کلی سنسور و محرک هوشمند.
تا به امروز، حسگرهای هوشمند کاربردهای گستردهای در مراقبتهای بهداشتی، رانندگی هوشمند، شهرهای هوشمند، کارخانههای صنعتی و شبکههای اینترنت اشیا، و همچنین در کنترل بیوراکتور پیدا کردهاند ( لی و همکاران، 2015 ؛ هرناندز-روجاس و همکاران، 2018 ؛ پرز و همکاران، 2018 ؛ ژانگ و همکاران، 2018 ). در یک مطالعه، لی و همکاران. (2015) یک سیستم حسگر هوشمند بی سیم مبتنی بر RFID، متشکل از یک برچسب حسگر RFID Pt_rGO و یک تحلیلگر شبکه متصل به آنتن خوان RFID، برای تشخیص گاز هیدروژن معرفی کرد. این حسگر دارای چشم اندازهای کاربردی گسترده ای در تشخیص گازهای محیطی، از جمله نظارت و کنترل فرآیندهای زیستی است ( لی و همکاران، 2015 ). در یک مطالعه جدیدتر، پرز و همکاران. (2018) یک حسگر هوشمند را معرفی کرد که برای نظارت بر رشد سلول در یک ریزچاه طراحی شده است. کشت سلولی مورد بررسی به عنوان یک “نوسانگر بیولوژیکی” برای استخراج سیگنالهای رشد سلولی و تعداد سلول عمل کرد. ژانگ و همکاران (2018) طراحی، ساخت و اجرای یک سیستم سنسور فشار هوشمند پیزورزمقاومتی آرایه ای از نوع MEMS را برای برآورده کردن الزامات حساسیت بالا و خطی بودن نظارت در رادیوسوند گزارش کرد. استفاده از حسگرهای هوشمند در این شرایط دارای مزایای مشخصی است، از جمله راه حل های تلفیقی تر برای نظارت بر فرآیند، نظارت همزمان بر تعداد زیادی از پارامترهای فرآیند، و راندمان بالای شبکه حسگر.
تحقیقات در مورد حسگرهای هوشمند
نیز به موضوع داغ در الکترونیک و علوم کامپیوتر تبدیل شده است و تأثیرات عمیقی بر بسیاری از زمینههای کاربردی دارد. ادغام اجزای ارتباطی و محاسباتی در سیستم حسگر هوشمند منجر به افزایش تقاضای انرژی شده است، به طوری که منبع تغذیه پایدار و کارآمد به یک موضوع حیاتی در توسعه حسگر هوشمند تبدیل شده است ( لین و همکاران، 2019 ). در بسیاری از شرایط کاربردی، یک شبکه حسگر بی سیم به یک انتخاب برتر تبدیل شده است ( Zhu et al., 2018 ). تحقیقات مربوط به ایمنی، کارایی و پایداری شبکه ارتباطی نیز به یک موضوع محبوب تبدیل شده است و استراتژی هایی مانند تعیین معیارهای مشترک از ابتدای طراحی حسگر هوشمند نیز برای مقابله با این نگرانی پیشنهاد شده است ( Bialas, 2010a , b ).
مفهوم محرک هوشمند دو تفسیر متفاوت دارد. در برخی از مطالعات، به محرک های ساخته شده از “مواد هوشمند” اشاره دارد که دارای ویژگی های ذاتی حسگرهای داخلی، محرک ها و مکانیسم های کنترلی در ریزساختار خود هستند. در مورد دوم، به یک ابزار هوشمند (مانند یک موتور DC یا شیرها) اشاره دارد که به عنوان یک محرک در کنترل فرآیند عمل می کند ( Barasuol et al., 2018 ). در اینجا ما در مورد عملگرهای هوشمند با توجه به تعریف دوم بحث خواهیم کرد. با توجه به تعریف اولیه ارائه شده توسط Staroswiecki و Bayart (1996) ، ساختار عملکردی معمولی محرک های هوشمند شامل اجزایی برای ارتباطات، مدیریت (شامل ورودی داده، اعتبارسنجی، بسط و مدیریت پایگاه داده)، تصمیم گیری و اقدام است.
با این حال، ساختار بتنی محرک های هوشمند برای کاربردهای خاص ممکن است متفاوت باشد. به عنوان یک گره ضروری FOCS برای بیوراکتورها، محرکهای هوشمند میتوانند سیگنالهایی را از حسگرها یا کنترلکنندههای هوشمند دریافت کنند و به این دستورالعملها برای کنترل فرآیند پاسخ دهند. در بیشتر موارد، محرکها و حسگرها از نظر فیزیکی از هم جدا هستند، مانند آنهایی که برای نظارت و کنترل pH، دما و DO استفاده میشوند. ارتباط بی سیم به محافظت از کابل در یک محیط سخت ترجیح داده می شود. در شرایط دیگر، محرک ها و حسگرها از نظر فیزیکی یکپارچه هستند، مانند مواردی که برای نظارت و کنترل سرعت چرخش انجام می شود. در چنین مواردی، تعامل بین سنسورها و محرک ها راحت تر است.
محرک های هوشمند به طور گسترده ای برای کنترل وسایل نقلیه و ربات ها و در صنعت بیوتکنولوژی مورد استفاده قرار گرفته اند ( پروتی و همکاران، 2006 ؛ ون لون، 2015 ؛ باراسوول و همکاران، 2018 ). پروتی و همکاران (2006) یک محرک هوشمند VHM را برای یک سیستم ذخیره سازی هیدروژن مایع با تاکید بر عملکرد خود تشخیصی آن گزارش کرد. Van Loon (2015) گزارش داد که استفاده از شیرهای هوشمند کنترل شده توسط FCS در یک کارخانه نوشیدنی، قابلیت اطمینان و کارایی خط تولید آن را افزایش داد. از آنجایی که دریچهها بخشهای عملکردی مهم بیوراکتورها و خطوط لوله مرتبط هستند، استفاده از محرکهای هوشمند مانند سیستم VHM میتواند به طور بالقوه پایداری و کنترلپذیری فرآیندهای زیستی را افزایش دهد. از آنجایی که محرکهای هوشمند عموماً در سیستمهای بزرگتر مورد استفاده قرار میگیرند، عملکرد مناسب آنها پیامدهای حیاتی برای تحقق اهداف تولید سطح بالاتر مانند بازده، پروفایلهای محصول جانبی و در نهایت، اقتصادی بودن فرآیند زیستی دارد.
سنسورهای چند پارامتری برای نظارت همزمان پارامترهای چندگانه فرآیند
حسگرهای چند پارامتری یکی دیگر از جهت گیری های جالب توسعه حسگر هوشمند هستند ( Bockisch et al., 2014 , 2019 ; Sardesai et al., 2015 ). در بیشتر موارد، بسیاری از پارامترهای فرآیند نیاز به نظارت همزمان برای توسعه فرآیند دارند و استفاده از سنسورهای چند پارامتری میتواند تعداد کل سنسورهای مورد استفاده را به طور چشمگیری کاهش دهد. سنسورهای چند پارامتری برای کاربردها در بسیاری از زمینه ها توسعه یافته اند. ادر و همکاران (2014) یک سنسور CMOS برای اندازهگیری ترکیبی دما و رطوبت بستههای میکرو برای مدارهای مجتمع کاشتهشده برای اطمینان از عملکرد ایمن آنها توسعه داد. وانگ و همکاران (2014) توسعه یک حسگر هوشمند را گزارش کرد که می تواند به طور همزمان شاخص بازتاب و دمای نمونه های آزمایش شده را با کاربردهای احتمالی در تحقیقات شیمیایی و بیولوژیکی اندازه گیری کند. بوکیش و همکاران (2014) استفاده از یک حسگر چند پارامتری متحرک را برای درجا فاز مایع در تخمیرهای مخمر صنعتی گزارش کرد. سردسایی و همکاران (2015) توسعه یک آشکارساز نوری مرکب را گزارش کرد که می تواند برای اندازه گیری همزمان pH و DO استفاده شود.
در حال حاضر، بیشتر حسگرهای مورد استفاده در سیستم های کنترل بیوراکتور برای اندازه گیری یک پارامتر طراحی شده اند. در نتیجه، دهانههای زیادی در بالا یا دیواره بیوراکتور تخمیر مورد نیاز است که ساخت آنها را پیچیدهتر و گرانتر میکند، خطر آلودگی را افزایش میدهد و بر ناراحتی عملکرد میافزاید. برعکس، استفاده از سنسورهای چند پارامتری طراحی شده برای نظارت همزمان چند پارامتر میتواند تعداد کل حسگرهای مورد استفاده در بیورآکتورها را تا حد زیادی کاهش دهد، بنابراین نیاز به تعداد دهانههای کمتری در طول فرآیند تولید، بهبود ایمنی و مقاومت در برابر آلودگی دارد. طراحی احتمالی یک سنسور چند پارامتری در شکل 6 . به عنوان مثال، عملکردهای اندازه گیری pH، دما و DO را می توان در یک سنسور هوشمند ادغام کرد. همچنین می توان یک آداپتور برای سنسورهای چند پارامتری به طور خاص برای پردازش سیگنال و ارتباطات ایجاد کرد. تجزیه و تحلیل طیفسنجی شامل NIR، Raman و طیفهای فلورسانس نیز یک استراتژی جایگزین برای توسعه حسگرهای چند پارامتری جدید ارائه میکند. وانگ و همکاران، 2014 ). استفاده از سنسورهای هوشمند چند پارامتری میتواند یکپارچگی سیستمهای کنترل را تا حد زیادی افزایش دهد و گردش کار را برای کارگران سادهتر کند.
 شکل 6. نمونه ای از معماری یک سنسور چند پارامتری برای نظارت همزمان چند پارامتر فرآیند.
شکل 6. نمونه ای از معماری یک سنسور چند پارامتری برای نظارت همزمان چند پارامتر فرآیند.
گسترش کاربرد سیستم های کنترل بیوراکتور پیشرفته در فرآیندهای زیستی مختلف
بیوراکتورهای مینیاتوری موازی برای توسعه فرآیندهای زیستی
بیورآکتورهای مینیاتوری موازی با حجم کاری کوچک (که سیستمهای میکروبیوراکتور نیز نامیده میشوند) جایگزین مهمی برای دستگاههای کشت دستهای سنتی برای استفاده در توسعه فرآیندهای زیستی و تحقیقات افزایش/کاهش مقیاس هستند. بسیاری از مطالعات مهم بحث مفصلی را در مورد این موضوع ارائه میکنند و بسیاری از محصولات تجاری (مانند DASGIP از Eppendorf، AMBR از Sartorius Stedim Biotech) نیز در بازار موجود هستند ( فاوست و همکاران، 2014 ؛ همریچ و همکاران، 2018a ؛ بیورک و Joensson، 2019 ؛ Sandner و همکاران، 2019 ؛ Znidarsic-Plazl، 2019 ). نظارت بر فرآیند و کنترل بیوراکتورهای مینیاتوری پیچیده تر از کنترل تک بیوراکتوری است، اما تحقیقات نتایج دلگرم کننده ای را نشان داده است. از منظر ساختاری، بیوراکتورهای مینیاتوری موازی را می توان به دو دسته تقسیم کرد، بیوراکتورهای مینیاتوری مبتنی بر میکروصفحه، ریز محفظه و میکروسیال، و راکتورهای مینیاتوری مبتنی بر مخزن همزن ( Hemmerich et al., 2018a ). برای بیوراکتورهای مینیاتوری مبتنی بر میکروپلیت، ریز محفظه و میکروسیال، سیستمهای نظارت و کنترل مبتنی بر حسگرهای نوری انتخابهای بسیار مؤثری هستند. مثلا، سیتا و همکاران (2005) توسعه یک سیستم میکروبیوراکتور چندگانه را برای بررسی فرآیندهای زیستی با توان بالا، با استفاده از گروهی از حسگرهای فیبر نوری برای نظارت همزمان OD، DO، و pH گزارش کرد. قابل توجه، منحنی های پارامتر فرآیند بسیار مشابه در مقایسه با یک سیستم کنترل مشاهده شد. طیفسنجی آنلاین رامان و استراتژیهای طراحی آزمایش نیز برای نظارت بر پارامترهای متابولیکی و فیزیولوژیکی متعدد فرهنگها در بیوراکتورهای مینیاتوری موازی اتخاذ شدهاند ( رولند جونز و ژاک، 2019 ). علاوه بر این، ادغام بیوراکتورهای مینیاتوری با دستگاههای نمونهبرداری رباتیک، PATهای سریع و نمونهبرداری با حجم کوچک تکراری نیز برای فنوتیپسازی کارآمد کشتها در میکروپلیتها، ریز محفظهها و دستگاههای میکروسیال مورد استفاده قرار گرفتهاند ( Morschett et al., 2017 ; Hemmerich et al., 2018b ). ادغام برنامه های طراحی آزمایش در سیستم کنترل و مدل سازی فرآیند مبتنی بر دانش نیز برای تسهیل توسعه فرآیندهای زیستی با استفاده از گروهی از بیوراکتورهای مینیاتوری استفاده شده است. مولر و همکاران، 2019 ). در بیورآکتورهای موازی مخزن همزده، تنها تعداد محدودی از پارامترها را می توان پایش کرد و باید روشهای جدیدی برای این فرآیندهای زیستی ایجاد شود. به عنوان مثال، Frachon و همکاران. (2006) یک باتری میکروفرمانتر چندگانه، هر کدام با حجم کاری 80 میلی لیتر، برای کشت های موازی خودکار میکروارگانیسم هایی که پروتئین های نوترکیب تولید می کنند و بهینه سازی پروتکل های کشت را توسعه دادند. سه پروب مینیاتوری برای پایش پارامتر استفاده شد. در بیوراکتورهای مینیاتوری موازی، نظارت و کنترل پارامترهای فرآیند با استفاده از سنسورهای سنتی، محرکها و HSCS منجر به فضای عملیاتی بسیار محدود در بالای بیوراکتورها میشود که باعث افزایش ناراحتی در عملکرد و خطر آلودگی میشود. استفاده از FOCS برای بیوراکتورها با حسگرها و محرک های هوشمند چند پارامتری، عملیات و نگهداری بیوراکتورهای مینیاتوری موازی را تسهیل می کند. از آنجایی که مهمترین کاربرد بیوراکتورهای مینیاتوری، کشت سلولی و ارزیابی فرآیند بوده است، علاوه بر عملکرد عادی کنترل و جمع آوری داده های سیستم های کنترل بیوراکتور، الزامات طراحی آزمایش، ارزیابی داده ها و ظرفیت های تجزیه و تحلیل باعث توسعه KBCS بیوراکتورهای مینیاتوری یک موضوع تحقیقاتی مهم ( Abt و همکاران، 2018 ).
بیوراکتورهای فرهنگ مستمر برای تحقیقات چند رشته ای مرزی
تحقیقات علوم زیستی یک وظیفه مهم در اکتشاف فضایی است و در مرز تحقیقات چند رشته ای قرار دارد که توجه بسیاری از کشورها را به خود جلب کرده است. به عنوان مثال، کشت مداوم ریزجلبک ها در یک بیوراکتور روشن به یک ایده بسیار جذاب برای بازسازی و کنترل O 2 در شرایط اضطراری در BLSS در اکتشاف فضا تبدیل شده است. نظارت و کنترل پایدار و مؤثر این سیستم پیچیده نیز به یک سیستم کنترل بیوراکتور قوی وابسته است ( هو و همکاران، 2012 ). توانایی ریزجلبک ها برای تبدیل نور خورشید و دی اکسید کربن به انرژی شیمیایی نیز توجه بسیاری از محققان دانشگاهی و صنعتی را به خود جلب کرده است. این موجودات می توانند محصولات متنوعی مانند پروتئین های با ارزش بالا، رنگدانه ها، اسیدهای چرب و سوخت های زیستی تولید کنند. تحقیق در مورد سینتیک رشد ریزجلبک ها و استراتژی های کنترل مناسب در فتوبیوراکتورهای مختلف موضوعات بسیاری از مطالعات مهم بوده است ( کولر و همکاران، 2017). ; Pfaffinger و همکاران، 2019 ). استفاده از FOCS برای بیوراکتورهای مبتنی بر حسگرها و محرکهای هوشمند میتواند پیچیدگی سختافزار مورد نیاز را کاهش دهد، که به نوبه خود، استحکام سیستم کنترل مستقل را افزایش میدهد. بر اساس FOCS برای بیوراکتورها، کشت مداوم طولانی مدت و حالت های کشت پیچیده تر می تواند به طور خودکار با وابستگی کمتر به دخالت انسان انجام شود. ALE یک رویکرد مؤثر برای بهینهسازی سیستماتیک فنوتیپهای سویه است و به طور گسترده در بیوتکنولوژی استفاده شده است. آزمایشهای سنتی ALE نیاز به عملیات مداوم انسان دارند. در یک آزمایش تکاملی بلندمدت، دو جمعیت اشرشیاکلی B برای 10000 نسل با محیط حداقل گلوکز سازگار شدند که سالها به طول انجامید ( لامرابت و همکاران، 2019 ). اخیرا، وونگ و همکاران. (2018) یک بیوراکتور به نام “eVOLVER” با FOCS برای کنترل دقیق و خودکار شرایط رشد برای کشت مخمر و باکتریها با توان تولید بالا توسعه داد. محرک های هوشمند برای کنترل دمای رشد از طریق یک گرم کننده با کنترل PID و یک شبکه اترنت برای انتقال داده بین ماژول های مختلف سیستم کنترل برای انجام عملکردهای انتقال سلول ویال به ویال و تبادل محیط کشت استفاده شد. اتوماسیون آزمایشهای ALE که توسط بیوراکتورها با FOCS پشتیبانی میشوند، این فرآیند را کارآمدتر و تکرارپذیرتر کرده است.
خلاصه و چشم انداز
در نتیجه، FOCSهای جدید برای بیوراکتورها از جمله FCSهای پیشرفته و NCSهای مبتنی بر حسگرها و محرکهای هوشمند، مرحله پیشرفتهای از کنترل فرآیند زیستی را در مقایسه با HSCSهای کلاسیک برای بیوراکتورها نشان میدهند. آنها دارای مزایای راندمان بالا، قابلیت همکاری و پایداری بالا، هزینه نگهداری کم و قابلیت مدیریت پیشرفته هستند، حتی اگر هنوز معایبی وجود دارد. در آینده، توسعه FOCS برای بیوراکتورها فرصت های بزرگی را ارائه می دهد. از یک منظر، پیشرفت سریع در زمینه فناوری اطلاعات و ارتباطات (به عنوان مثال، 5G و IoT)، مهندسی مکانیک، و تحقیقات مرزی در علوم پایه، توسعه حسگرها/عملگرهای هوشمند، کانالهای ارتباطی، و سایر اجزاء سیستم کنترل بنابراین، FOCSهای بیوراکتور ممکن است به طور مداوم به مرحله پیشرفتهتری تبدیل شوند. از منظری دیگر، بیوتکنولوژی مدرن وارد عصر زیستشناسی مصنوعی و زیستشناسی سیستمی شده است که ایدهها، ابزارها و روشهای جدیدی را برای درک بیشتر عوامل مهم مؤثر بر فرآیندهای زیستی ارائه کرده است. با درک عمیقتر مکانیسمهای واکنش زیستفرآیند خاص و دانش روزافزون از دینامیک فرآیند، بیوراکتورهای KBCS مبتنی بر ظرفیت محاسباتی قدرتمند از طریق هوش مصنوعی و محاسبات ابری مؤثرتر و قابل اعتمادتر خواهند شد. این به نوبه خود، ممکن است بهینه سازی FOCSهای بیوراکتور را بیشتر تحریک کند و به کنترل فرآیندهای زیستی کمک کند.
مشارکت های نویسنده
BW این اثر را طراحی کرد، موضوعات مرتبط را بررسی کرد و نسخه خطی را نوشت. ZW، TC و XZ در مورد موضوع بحث کردند و نسخه خطی را ویرایش و اصلاح کردند. همه نویسندگان انتشار این اثر را تایید کردند.
منابع مالی
این کار توسط برنامه تحقیق و توسعه کلید ملی چین (2018YFA0900200) و بنیاد ملی علوم طبیعی چین (NSFC-21621004، NSFC-21776208، و NSFC-21776209) پشتیبانی شده است.
تضاد منافع
نویسندگان اعلام می کنند که این تحقیق در غیاب هر گونه روابط تجاری یا مالی که می تواند به عنوان تضاد منافع بالقوه تعبیر شود، انجام شده است.
قدردانی ها
ما از پروفسور Qinghong Wang (TIB، CAS) برای بحث در مورد بیوراکتورهای قابل برنامه ریزی برای تخمیر مداوم طولانی مدت تشکر می کنیم، و همچنین می خواهیم از پروفسور Wenxia Jiang (TIB، CAS) برای بحث در مورد تأسیسات تولید صنعتی تشکر کنیم.
اختصارات
μ SI، تزریق متوالی میکرو؛ A/D، آنالوگ/دیجیتال؛ هوش مصنوعی، هوش مصنوعی؛ ALE، تکامل آزمایشگاهی تطبیقی. BLSS، سیستم پشتیبانی حیات زیستی؛ CMOS، نیمه هادی اکسید فلزی مکمل؛ D/A، دیجیتال/آنالوگ؛ DCS، سیستم کنترل توزیع شده؛ DIY، خودتان آن را انجام دهید. DO، اکسیژن محلول؛ DOE، طراحی آزمایش. DoS، انکار سرویس؛ FCS، سیستم کنترل فیلدباس؛ FF، فیلدباس بنیاد؛ FIA، تجزیه و تحلیل تزریق جریان.
FOCS، سیستم کنترل سازمانی مسطح؛ HSCS، سیستم کنترل ساختار سلسله مراتبی. اینترنت اشیا، اینترنت اشیا؛ KBCS، سیستم کنترل مبتنی بر دانش؛ MES، سیستم اجرای تولید؛ MEMS، سیستم میکروالکترومکانیکی؛ NCS، سیستم کنترل شبکه ای؛ NIR،
مادون قرمز نزدیک؛ OD، چگالی نوری؛ سیستم عامل، سیستم عامل؛ PAT، تکنیک تحلیلی فرآیند. PTR-ToF-MS، واکنش انتقال پروتون با طیف سنج جرمی زمان پرواز. PID، متناسب-انتگرال-مشتق. PLC، کنترل کننده منطقی قابل برنامه ریزی؛ Pt_rGO، اکسید گرافن احیا شده با تزئین پلاتین. RFID، شناسایی فرکانس رادیویی؛ UPLC، کروماتوگرافی مایع با عملکرد فوق العاده؛ VHM، مانیتور سلامت سوپاپ.