سیال فوق بحرانی ( SCF ) هر ماده ای در دما و فشار خود بالاتر از نقطه بحرانی متمایز است، که در آن فازهای مایع و گاز وجود ندارد، اما کمتر از فشار مورد نیاز برای فشرده کردن آن به یک جامد است. میتواند نفوذ کند از طریق جامدات متخلخل مانند گاز و بر محدودیتهای انتقال جرم که انتقال مایع را از طریق چنین موادی کند میکند، غلبه کند. موادی مانند مایعات یا جامدات بسیار برتر از گازها هستند SCF در توانایی آنها برای حل کردن . همچنین، در نزدیکی نقطه بحرانی، تغییرات کوچک در فشار یا دما منجر به تغییرات بزرگ در چگالی میشود که به بسیاری از ویژگیهای یک سیال فوق بحرانی اجازه میدهد تا به خوبی تنظیم شوند.
سیالات فوق بحرانی در اتمسفر غول های گازی مشتری و زحل ، سیاره زمینی زهره ، و احتمالاً در جو غول های یخی اورانوس و نپتون رخ می دهند . آب فوق بحرانی در زمین یافت می شود ، مانند آبی که از سیگاری های سیاه پوست خارج می شود ، که نوعی دریچه هیدروترمال زیر آب است. آنها به عنوان جایگزینی برای آلی حلال های در طیف وسیعی از فرآیندهای صنعتی و آزمایشگاهی استفاده می شوند. دی اکسید کربن و آب رایج ترین سیالات فوق بحرانی هستند. آنها اغلب برای کافئین زدایی و تولید برق استفاده می شوند . یک ویژگی جالب این است که برخی از مواد در حالت فوق بحرانی یک حلال (مثلا دی اکسید کربن) محلول هستند اما در حالت گاز یا مایع نامحلول هستند – یا برعکس. این می تواند برای استخراج یک ماده و انتقال آن به جای دیگر در محلول قبل از رسوب در محل مورد نظر با اجازه دادن یا القای انتقال فاز در حلال استفاده شود.
خواص سیال فوق بحرانی
سیالات فوق بحرانی معمولاً دارای خواصی بین گاز و مایع هستند. در جدول 1، خواص بحرانی برای برخی از موادی که معمولاً به عنوان سیالات فوق بحرانی استفاده می شوند نشان داده شده است.
| حلال | جرم مولکولی | دمای بحرانی | فشار بحرانی | چگالی بحرانی |
|---|---|---|---|---|
| g/mol | ک | MPa ( ATM ) | گرم بر سانتی متر 3 | |
| دی اکسید کربن (CO 2 ) | 44.01 | 304.1 | 7.38 (72.8) | 0.469 |
| آب (H 2 O) † | 18.015 | 647.096 | 22.064 (217.755) | 0.322 |
| متان (CH 4 ) | 16.04 | 190.4 | 4.60 (45.4) | 0.162 |
| اتان (C 2 H 6 ) | 30.07 | 305.3 | 4.87 (48.1) | 0.203 |
| پروپان (C 3 H 8 ) | 44.09 | 369.8 | 4.25 (41.9) | 0.217 |
| اتیلن (C 2 H 4 ) | 28.05 | 282.4 | 5.04 (49.7) | 0.215 |
| پروپیلن (C 3 H 6 ) | 42.08 | 364.9 | 4.60 (45.4) | 0.232 |
| متانول (CH 3 OH) | 32.04 | 512.6 | 8.09 (79.8) | 0.272 |
| اتانول ( C2H5OH _ _ ) | 46.07 | 513.9 | 6.14 (60.6) | 0.276 |
| استون (C 3 H 6 O) | 58.08 | 508.1 | 4.70 (46.4) | 0.278 |
| اکسید نیتروژن (N 2 O) | 44.013 | 306.57 | 7.35 (72.5) | 0.452 |
†منبع: انجمن بین المللی خواص آب و بخار ( IAPWS ) [4]
جدول 2 چگالی، انتشار و ویسکوزیته را برای مایعات، گازها و سیالات فوق بحرانی معمولی نشان می دهد.
| چگالی (kg/ m3 ) | ویسکوزیته ( μPa·s ) | نفوذپذیری (mm2 / s) | |
|---|---|---|---|
| گازها | 1 | 10 | 1-10 |
| سیالات فوق بحرانی | 100-1000 | 50-100 | 0.01-0.1 |
| مایعات | 1000 | 500-1000 | 0.001 |
در سیال فوق بحرانی وجود ندارد همچنین، هیچ کشش سطحی ، زیرا مرز فاز مایع/گاز وجود ندارد. با تغییر فشار و دمای سیال، می توان خواص را به گونه ای تنظیم کرد که بیشتر شبیه مایع یا گاز مانند باشد. یکی از مهمترین خواص حلالیت مواد در سیال است. حلالیت در یک سیال فوق بحرانی با چگالی سیال (در دمای ثابت) افزایش می یابد. از آنجایی که چگالی با فشار افزایش می یابد، حلالیت تمایل به افزایش با فشار دارد. رابطه با دما کمی پیچیده تر است. در چگالی ثابت، حلالیت با دما افزایش می یابد. با این حال، نزدیک به نقطه بحرانی، چگالی می تواند به شدت با افزایش جزئی دما کاهش یابد. بنابراین، نزدیک به دمای بحرانی، حلالیت اغلب با افزایش دما کاهش می یابد، سپس دوباره افزایش می یابد.
مخلوط ها
به طور معمول، سیالات فوق بحرانی کاملاً قابل اختلاط با یکدیگر هستند، به طوری که اگر از نقطه بحرانی مخلوط فراتر رود، یک مخلوط دوتایی یک فاز گازی واحد را تشکیل می دهد. با این حال، استثنائات در سیستم هایی شناخته شده است که یک جزء بسیار فرارتر از دیگری است، که در برخی موارد دو فاز گاز غیرقابل اختلاط را در فشار بالا و دماهای بالاتر از نقاط بحرانی جزء تشکیل می دهند. این رفتار به عنوان مثال در سیستم های N 2 -NH 3 ، NH 3 -CH 4 ، SO 2 -N 2 و n-butane-H 2 O یافت شده است.
نقطه بحرانی یک مخلوط دوتایی را می توان به عنوان میانگین حسابی دماها و فشارهای بحرانی دو جزء تخمین زد.
جایی که χ i نشان دهنده کسر مولی جزء i است .
برای دقت بیشتر، نقطه بحرانی را می توان با استفاده از معادلات حالت ، مانند روش پنگ-رابینسون ، یا روش های مشارکت گروهی محاسبه کرد . خواص دیگر مانند چگالی را نیز می توان با استفاده از معادلات حالت محاسبه کرد. [8]
نمودار فاز

شکل های 1 و 2 پیش بینی های دو بعدی یک نمودار فاز را نشان می دهند . در نمودار فاز فشار و دما (شکل 1) منحنی جوش جدا می کند ناحیه گاز و مایع را و به نقطه بحرانی ختم می شود، جایی که فازهای مایع و گاز ناپدید می شوند و به یک فاز فوق بحرانی تبدیل می شوند.
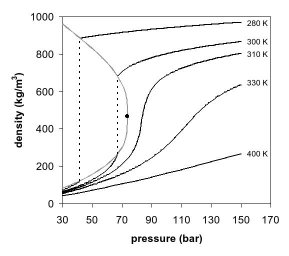
ظاهر یک فاز را می توان در نمودار فاز چگالی فشار برای دی اکسید کربن نیز مشاهده کرد (شکل 2). در دمای بسیار پایینتر از دمای بحرانی، به عنوان مثال، 280 کلوین، با افزایش فشار، گاز فشرده میشود و در نهایت (در دمای بیش از 40 بار ) به مایع بسیار متراکمتری تبدیل میشود که منجر به ناپیوستگی در خط میشود (خط نقطهچین عمودی). این سیستم شامل 2 فاز در حالت تعادل ، یک مایع متراکم و یک گاز با چگالی کم است. با نزدیک شدن به دمای بحرانی (300 کلوین)، چگالی گاز در حالت تعادل بیشتر و چگالی مایع کمتر میشود. در نقطه بحرانی (304.1 K و 7.38 مگاپاسکال (73.8 بار))، تفاوتی در چگالی وجود ندارد و 2 فاز به یک فاز سیال تبدیل می شوند. بنابراین، بالاتر از دمای بحرانی، یک گاز نمی تواند با فشار مایع شود. در کمی بالاتر از دمای بحرانی (310 K)، در مجاورت فشار بحرانی، خط تقریبا عمودی است. افزایش اندک فشار باعث افزایش زیادی در چگالی فاز فوق بحرانی می شود. بسیاری از خواص فیزیکی دیگر نیز گرادیان های بزرگ با فشار نزدیک به نقطه بحرانی را نشان می دهند، به عنوان مثال ویسکوزیته ، گذردهی نسبی و قدرت حلال، که همگی با چگالی مرتبط هستند. در دماهای بالاتر، سیال شروع به رفتار بیشتر شبیه یک گاز ایده آل می کند، با رابطه چگالی/فشار خطی تر، همانطور که در شکل 2 مشاهده می شود. برای دی اکسید کربن در 400 K، چگالی تقریباً به صورت خطی با فشار افزایش می یابد.
بسیاری از گازهای تحت فشار در واقع سیالات فوق بحرانی هستند. به عنوان مثال، نیتروژن دارای یک نقطه بحرانی 126.2 K (-147 درجه سانتیگراد) و 3.4 مگاپاسکال (34 بار) است. بنابراین، نیتروژن (یا هوای فشرده) در سیلندر گاز بالاتر از این فشار در واقع یک سیال فوق بحرانی است. اینها بیشتر به عنوان گازهای دائمی شناخته می شوند. در دمای اتاق، آنها بسیار بالاتر از دمای بحرانی خود هستند، و بنابراین به عنوان یک گاز تقریبا ایده آل، مشابه CO 2 در 400 K بالا رفتار می کنند. با این حال، آنها را نمی توان با فشار مکانیکی مایع کرد، مگر اینکه در دمای بحرانی خود خنک شوند، که به فشار گرانشی مانند غول های گازی برای تولید مایع یا جامد در دماهای بالا نیاز دارد. . بالاتر از دمای دهد بحرانی، فشارهای بالا می تواند چگالی را به اندازه ای افزایش دهد که SCF چگالی و رفتار مایع مانندی از خود نشان در فشارهای بسیار بالا، یک SCF را می توان به صورت جامد فشرده کرد، زیرا منحنی ذوب به سمت راست نقطه بحرانی در نمودار فاز P/T گسترش می یابد. در حالی که فشار مورد نیاز برای فشرده سازی CO فوق بحرانی 2 به یک جامد بسته به دما می تواند تا 570 مگاپاسکال باشد، که برای جامد شدن آب فوق بحرانی 14000 مگاپاسکال نیاز است.
خط فیشر -ویدام ، خط Widom ، یا خط فرنکل مفاهیم ترمودینامیکی هستند که امکان تشخیص حالتهای مایع و گاز مانند را در سیال فوق بحرانی فراهم میکنند.
در سال های اخیر، تلاش قابل توجهی به بررسی خواص مختلف سیالات فوق بحرانی اختصاص یافته است. این یک زمینه هیجان انگیز با سابقه طولانی بوده است از سال 1822 زمانی که بارون چارلز کاگنیارد د لا تور در حین انجام آزمایش هایی که شامل ناپیوستگی صدا در لوله تفنگ مهر و موم شده پر از سیالات مختلف در دمای بالا بود، سیالات فوق بحرانی را کشف کرد. اخیراً، سیالات فوق بحرانی در زمینههای مختلفی کاربرد پیدا کردهاند، از استخراج عطر گلها از گلها گرفته تا کاربردها در علوم غذایی مانند ایجاد قهوه بدون کافئین، مواد غذایی کاربردی، داروسازی، لوازم آرایشی، پلیمرها، پودرها، مواد زیستی. – و مواد کاربردی، سیستم های نانو، محصولات طبیعی، بیوتکنولوژی، فسیلی و سوخت های زیستی، میکروالکترونیک، انرژی و محیط زیست. بخش اعظم هیجان و علاقه دهه گذشته به دلیل پیشرفت عظیمی است که در افزایش قدرت ابزارهای تجربی مربوطه انجام شده است. توسعه روشهای آزمایشی جدید و بهبود روشهای موجود همچنان نقش مهمی در این زمینه ایفا میکند، با تحقیقات اخیر بر روی خواص دینامیکی سیالات.
رویداد طبیعی سیال فوق بحرانی
گردش هیدروترمال سیال فوق بحرانی

گردش گرمابی در داخل پوسته زمین هر جا که سیال گرم می شود و شروع به همرفت می کند، رخ می دهد. تصور می شود که این سیالات تحت تعدادی تنظیمات مختلف به شرایط فوق بحرانی می رسند، مانند تشکیل رسوبات مس پورفیری یا گردش آب دریا در دمای بالا در کف دریا. در پشته های میانی اقیانوسی، این گردش بیشتر با ظهور دریچه های گرمابی معروف به “سیگاری های سیاه” مشهود است. اینها دودکش های بزرگ (به ارتفاع متر) از مواد معدنی سولفیدی و سولفاتی هستند که سیالات را تا 400 درجه سانتیگراد تخلیه می کنند. این سیالات به دلیل رسوب فلزات محلول در سیال مانند ابرهای دود بزرگ سیاه و سفید ظاهر می شوند. این احتمال وجود دارد که در عمق، بسیاری از این دریچهها به شرایط فوق بحرانی میرسند، اما اکثر آنها تا زمانی که به کف دریا میرسند به اندازه کافی خنک میشوند تا زیر بحرانی باشند. یک سایت خاص دریچه، گودال لاک پشت، دوره کوتاهی از فوق بحرانی بودن را در محل دریچه نمایش داده است. تصور میشود که یک سایت دیگر، Beebe ، در Cayman Trough، فوق بحرانی پایدار را در دهانه دریچه نشان میدهد.
سیال فوق بحرانی جو سیاره ای
جو زهره 96.5 درصد دی اکسید کربن و 3.5 درصد نیتروژن است. فشار سطح 9.3 مگاپاسکال (93 بار) و دمای سطح 735 کلوین است که بالاتر از نقاط بحرانی هر دو جزء اصلی است و جو سطح را به یک سیال فوق بحرانی تبدیل می کند.
منظومه شمسی جو داخلی سیارات غول گازی عمدتاً از هیدروژن و هلیوم در دمای بسیار بالاتر از نقاط بحرانی آنها تشکیل شده است. اتمسفر بیرونی گازی مشتری و زحل به آرامی به درون مایع متراکم منتقل می شود، در حالی که ماهیت مناطق انتقالی نپتون و اورانوس ناشناخته است. مدلهای نظری سیاره فراخورشیدی Gliese 876 d اقیانوسی از آب سیال تحت فشار و فوق بحرانی را با ورقهای از یخ آب پرفشار جامد در پایین نشان دادهاند.
کاربرد سیال فوق بحرانی
استخراج سیال فوق بحرانی
مزایای استخراج سیال فوق بحرانی (در مقایسه با استخراج مایع) این است که به دلیل ویسکوزیته کم و انتشار زیاد مرتبط با سیالات فوق بحرانی، نسبتا سریع است. حلال های جایگزین برای سیالات فوق بحرانی ممکن است سمی، قابل اشتعال یا خطرات زیست محیطی بسیار بیشتری نسبت به آب یا دی اکسید کربن باشند. استخراج می تواند تا حدی با کنترل چگالی محیط انتخابی باشد و ماده استخراج شده به راحتی با کاهش فشار ساده بازیابی می شود و به سیال فوق بحرانی اجازه می دهد تا به فاز گاز برگردد و تبخیر شود و باقیمانده حلال کمی باقی بگذارد یا هیچ باقی بماند. دی اکسید کربن رایج ترین حلال فوق بحرانی است. استفاده می شود در مقیاس وسیع برای کافئین زدایی از دانه های قهوه سبز، استخراج رازک برای تولید آبجو، و تولید اسانس و محصولات دارویی از گیاهان. چند آزمایشگاهی روش آزمایش شامل استفاده از استخراج سیال فوق بحرانی به عنوان یک روش استخراج به جای استفاده از روش سنتی است. حلال ها.
تجزیه سیال فوق بحرانی
از آب فوق بحرانی می توان برای تجزیه زیست توده از طریق گازسازی زیست توده آب فوق بحرانی استفاده کرد. این نوع گازسازی زیست توده می تواند برای تولید سوخت های هیدروکربنی برای استفاده در یک دستگاه احتراق کارآمد یا برای تولید هیدروژن برای استفاده در پیل سوختی استفاده شود. در مورد دوم، بازده هیدروژن می تواند بسیار بیشتر از محتوای هیدروژن زیست توده به دلیل اصلاح بخار باشد که در آن آب یک شرکت کننده هیدروژن در واکنش کلی است.
خشک شویی
دی اکسید کربن فوق بحرانی (SCD) را می توان به جای PERC ( پرکلرواتیلن ) یا سایر حلال های نامطلوب برای تمیز کردن خشک استفاده کرد . دی اکسید کربن فوق بحرانی گاهی اوقات به دکمهها تبدیل میشود و وقتی SCD کمفشار میشود، دکمهها پاپ میزنند یا از هم میشکنند. مواد شوینده محلول در دی اکسید کربن قدرت حلال کنندگی حلال را بهبود می بخشد. [19] CO 2 تجهیزات خشکشویی مبتنی بر از CO 2 مایع و نه CO 2 فوق بحرانی استفاده می کنند تا از آسیب به دکمه ها جلوگیری کنند.
کروماتوگرافی سیال فوق بحرانی
کروماتوگرافی سیال فوق بحرانی (SFC) می تواند در مقیاس تحلیلی مورد استفاده قرار گیرد، جایی که بسیاری از مزایای کروماتوگرافی مایع با کارایی بالا (HPLC) و کروماتوگرافی گازی (GC) را ترکیب می کند. میتوان آن را با آنالیتهای غیرفرار و حساس به حرارت (برخلاف GC) استفاده کرد و میتوان آن را با آشکارساز یونیزاسیون شعله جهانی (برخلاف HPLC) و همچنین تولید پیکهای باریکتر به دلیل انتشار سریع استفاده کرد. در عمل، مزایای ارائه شده توسط SFC برای جابجایی HPLC و GC به طور گسترده مورد استفاده کافی نبوده است، به جز در موارد معدودی مانند جداسازی کایرال و تجزیه و تحلیل هیدروکربن های با وزن مولکولی بالا. [20] برای ساخت، واحدهای بستر متحرک شبیه سازی شده آماده سازی کارآمد موجود هستند. خلوص محصولات نهایی بسیار بالا است، اما هزینه آن را فقط برای مواد بسیار با ارزش مانند داروها مناسب می کند.
واکنش های شیمیایی
تغییر شرایط حلال واکنش می تواند باعث جداسازی فازها برای حذف محصول یا تک فاز برای واکنش شود. انتشار سریع واکنش های کنترل شده با انتشار را تسریع می کند. دما و فشار می توانند واکنش را در مسیرهای ترجیحی تنظیم کنند، به عنوان مثال، برای بهبود عملکرد یک کایرال ایزومر خاص. همچنین مزایای زیست محیطی قابل توجهی نسبت به حلال های آلی معمولی وجود دارد. سنتزهای صنعتی که در شرایط فوق بحرانی انجام می شود شامل پلی اتیلن از اتن فوق بحرانی ، ایزوپروپیل الکل از پروپن فوق بحرانی ، 2-بوتانول از بوتن فوق بحرانی ، و آمونیاک از مخلوط فوق بحرانی نیتروژن و هیدروژن است . واکنشهای دیگر، در گذشته، به صورت صنعتی در شرایط فوق بحرانی انجام میشد، از جمله سنتز متانول و کراکینگ روغن حرارتی (غیر کاتالیزوری). به دلیل توسعه کاتالیزورهای موثر ، دمای مورد نیاز این دو فرآیند کاهش یافته و دیگر فوق بحرانی نیستند.
اشباع و رنگرزی
اشباع، در اصل، معکوس استخراج است. ماده ای در سیال فوق بحرانی حل می شود، محلول از کنار یک بستر جامد عبور می کند و روی بستر رسوب می کند یا در آن حل می شود. رنگرزی که به راحتی بر روی الیاف پلیمری مانند پلی استر با استفاده از رنگهای پراکنده (غیر یونی) انجام می شود ، یک مورد خاص از این امر است. دی اکسید کربن همچنین در بسیاری از پلیمرها حل می شود و به طور قابل توجهی آنها را متورم و پلاستیک می کند و روند انتشار را تسریع می کند.
تشکیل ذرات نانو و میکرو
تشکیل ذرات کوچک یک ماده با توزیع اندازه باریک فرآیند مهمی در صنایع داروسازی و سایر صنایع است. سیالات فوق بحرانی با فراتر رفتن سریع از نقطه اشباع یک املاح با رقت کردن، کاهش فشار یا ترکیبی از اینها، راههایی را برای دستیابی به این هدف فراهم میکنند. این فرآیندها در سیالات فوق بحرانی سریعتر از مایعات اتفاق می افتند و باعث ایجاد هسته یا تجزیه اسپینودال بر روی رشد کریستال می شوند و ذرات بسیار کوچک و با اندازه منظم تولید می کنند. سیالات فوق بحرانی اخیر توانایی کاهش ذرات را تا محدوده 5 تا 2000 نانومتر نشان داده اند. [23]
تولید کریستال های دارویی
سیالات فوق بحرانی به عنوان یک رسانه جدید برای تولید اشکال کریستالی جدید API ها (مواد تشکیل دهنده فعال دارویی) به نام کریستال های دارویی عمل می کنند. فناوری سیال فوق بحرانی پلت فرم جدیدی را ارائه می دهد که امکان تولید تک مرحله ای از ذرات را فراهم می کند که به دست آوردن آنها با تکنیک های سنتی دشوار یا حتی غیرممکن است. تولید کریستالهای جدید خالص و خشک شده (کمپلکسهای مولکولی کریستالی شامل API و یک یا چند کنفورمور در شبکه کریستالی) را میتوان به دلیل خواص منحصر به فرد SCF با استفاده از خواص مختلف سیال فوق بحرانی به دست آورد: قدرت حلال CO 2 فوق بحرانی، ضد حلال . اثر و افزایش اتمیزه شدن آن
خشک کردن فوق بحرانی
خشک کردن فوق بحرانی روشی برای حذف حلال بدون اثرات کشش سطحی است. همانطور که یک مایع خشک می شود، کشش سطحی روی ساختارهای کوچک درون یک جامد کشیده می شود و باعث اعوجاج و انقباض می شود. در شرایط فوق بحرانی هیچ کشش سطحی وجود ندارد و سیال فوق بحرانی را می توان بدون اعوجاج حذف کرد. خشک کردن فوق بحرانی در فرآیند تولید آئروژل ها و خشک کردن مواد ظریف مانند نمونه های باستان شناسی و نمونه های بیولوژیکی برای میکروسکوپ الکترونی استفاده می شود .
الکترولیز آب فوق بحرانی
الکترولیز آب در حالت فوق بحرانی، مازاد پتانسیل موجود در سایر الکترولیزها را کاهش می دهد و در نتیجه راندمان الکتریکی تولید اکسیژن و هیدروژن را بهبود می بخشد.
افزایش دما باعث کاهش موانع ترمودینامیکی و افزایش سینتیک می شود. هیچ حباب اکسیژن یا هیدروژن روی الکترودها تشکیل نمی شود، بنابراین هیچ لایه عایق بین کاتالیزور و آب تشکیل نمی شود و تلفات اهمی را کاهش می دهد. خواص گاز مانند انتقال جرم سریع را فراهم می کند.
اکسیداسیون آب فوق بحرانی
اکسیداسیون آب فوق بحرانی از آب فوق بحرانی به عنوان محیطی برای اکسید کردن ضایعات خطرناک استفاده می کند و تولید محصولات احتراق سمی را که سوختن می تواند تولید کند حذف می کند.
محصول زایدی که باید اکسید شود در آب فوق بحرانی همراه با اکسیژن مولکولی (یا یک عامل اکسید کننده که پس از تجزیه اکسیژن را از دست می دهد، به عنوان مثال پراکسید هیدروژن ) حل می شود که در آن نقطه واکنش اکسیداسیون رخ می دهد.
هیدرولیز آب فوق بحرانی
هیدرولیز فوق بحرانی روشی برای تبدیل تمام پلی ساکاریدهای زیست توده و همچنین لیگنین مرتبط به ترکیبات مولکولی کم از طریق تماس با آب به تنهایی در شرایط فوق بحرانی است. آب فوق بحرانی به عنوان یک حلال، تامین کننده انرژی حرارتی شکستن پیوند، عامل انتقال حرارت و به عنوان منبع اتم های هیدروژن عمل می کند. همه پلی ساکاریدها در یک ثانیه یا کمتر با عملکرد کمی به قندهای ساده تبدیل می شوند. پیوندهای آلیفاتیک بین حلقهای لیگنین نیز به آسانی به رادیکالهای آزاد تبدیل میشوند که توسط هیدروژن منشاء آب تثبیت میشوند. حلقههای معطر لیگنین تحت زمانهای واکنش کوتاه تحت تأثیر قرار نمیگیرند، به طوری که محصولات مشتق شده از لیگنین، فنلهای مخلوط با وزن مولکولی کم هستند. برای استفاده از زمان واکنش بسیار کوتاه مورد نیاز برای برش، باید یک سیستم واکنش پیوسته ابداع شود. در نتیجه مقدار آب گرم شده تا حالت فوق بحرانی به حداقل می رسد.
تبدیل به گاز آب فوق بحرانی
2 تبدیل شدن جریانهای زیست توده آبی به آب تمیز و گازهایی مانند H , CH 4 , CO 2 , CO و غیره .
سیال فوق بحرانی در تولید برق
کارایی بستگی یک موتور حرارتی در نهایت به اختلاف دمای بین منبع گرما و سینک ( چرخه کارنو ) دارد. برای بهبود راندمان نیروگاه ها، دمای عملیاتی باید افزایش یابد. با استفاده از آب به عنوان سیال کار، آن را به شرایط فوق بحرانی می برد. [27] راندمان را می توان از حدود 39٪ برای عملیات زیر بحرانی به حدود 45٪ با استفاده از فناوری فعلی افزایش داد. [28] راکتورهای آب فوق بحرانی (SCWR) سیستمهای هستهای پیشرفته امیدوارکنندهای هستند که بهرهوری حرارتی مشابهی را ارائه میدهند. دی اکسید کربن همچنین می تواند در نیروگاه های هسته ای چرخه فوق بحرانی با افزایش بهره وری مشابه استفاده شود. [29] بسیاری از ژنراتورهای بخار فوق بحرانی با سوخت زغال سنگ در سرتاسر جهان فعال هستند و کارایی نیروگاه های بخار سنتی را افزایش داده اند. دی اکسید کربن فوق بحرانی نیز به عنوان یک سیال فعال پیشنهاد شده است که از مزیت فشار بحرانی کمتری نسبت به آب برخوردار است، اما مسائل مربوط به خوردگی هنوز به طور کامل حل نشده است. یکی از کاربردهای پیشنهادی این است سیکل علام . هم دی اکسید کربن و هم آب تعدیل کننده نوترون هستند ، اما چگالی آنها به عنوان سیالات فوق بحرانی کمتر از آب مایع است. این به راکتورهای هستهای با آن سیالات فوق بحرانی به عنوان خنککننده اولیه اجازه میدهد در حالت اعتدال کاهشیافته (“نیمه سریع” یا “اپی ترمال”) کار کنند، اما نه معمولا به عنوان یک نوترونی سریع راکتور . از سوی دیگر، مقداری تعدیل اضافی باید برای طیف نوترون کاملاً حرارتی ارائه شود.
سیال فوق بحرانی تولید بیودیزل
تبدیل روغن نباتی به بیودیزل از طریق یک ترانس استریفیکاسیون واکنش انجام می شود که در آن تری گلیسیرید به متیل استرها (اسیدهای چرب) به اضافه گلیسرول تبدیل می شود . این کار معمولاً با استفاده از متانول و کاتالیزورهای سوزاننده یا اسیدی انجام می شود، اما می توان با استفاده از متانول فوق بحرانی بدون کاتالیزور به دست آورد. روش استفاده از متانول فوق بحرانی برای تولید بیودیزل ابتدا توسط ساکا و همکارانش مورد مطالعه قرار گرفت. این مزیت اجازه می دهد تا محدوده و محتوای آب بیشتری از مواد اولیه (به ویژه روغن پخت و پز استفاده شده) بیشتر شود، محصول برای حذف کاتالیزور نیازی به شستن ندارد و طراحی آن به عنوان یک فرآیند مداوم آسان تر است.
بهبود بازیافت نفت و جذب و ذخیره کربن
دی اکسید کربن فوق بحرانی برای افزایش بازیافت نفت در میادین نفتی بالغ استفاده می شود. در عین حال، امکان استفاده از ” فناوری زغال سنگ پاک ” برای ترکیب روش های بهبود یافته بازیابی با ترسیب کربن وجود دارد . CO 2 از سایر گازهای دودکش جدا می شود، تا حالت فوق بحرانی فشرده می شود و به انبارهای زمین شناسی، احتمالاً به میادین نفتی موجود برای بهبود بازده تزریق می شود.
در حال حاضر، تنها طرحهایی که CO 2 فسیلی را از گاز طبیعی جدا میکنند، در واقع از ذخیرهسازی کربن استفاده میکنند، (به عنوان مثال، میدان گازی Sleipner )، قبل یا پس از احتراق وجود دارد ، اما برنامههای زیادی برای طرحهای CCS آینده شامل CO2 . همچنین امکان کاهش مقدار CO 2 در جو با استفاده از زیست توده برای تولید نیرو و جداسازی CO 2 تولید شده وجود دارد.
سیستم زمین گرمایی پیشرفته
استفاده از دی اکسید کربن فوق بحرانی، به جای آب، به عنوان یک سیال کار زمین گرمایی مورد بررسی قرار گرفته است.
سیال فوق بحرانی تبرید
با دمای بالا در حال ظهور است دی اکسید کربن فوق بحرانی نیز به عنوان یک مبرد استفاده می شود CFC / HFC خانگی جدید بدون و در پمپ های حرارتی استفاده می کنند که از چرخه عبوری. این سیستم ها در حال توسعه مداوم با پمپ های حرارتی دی اکسید کربن فوق بحرانی هستند که در حال حاضر با موفقیت در آسیا به بازار عرضه شده اند. سیستمهای EcoCute ژاپن از اولین پمپهای گرمای آب خانگی با دمای بالا هستند.
رسوب سیال فوق بحرانی
سیالات فوق بحرانی را می توان برای رسوب فیلم های نانوساختار کاربردی و ذرات نانومتری فلزات بر روی سطوح استفاده کرد. انتشار و غلظت بالای پیش ماده در سیال در مقایسه با سیستم های خلاء مورد استفاده در رسوب بخار شیمیایی، اجازه می دهد تا رسوب در یک رژیم محدود با سرعت واکنش سطحی رخ دهد و رشد سطحی پایدار و یکنواختی را فراهم می کند. این امر در توسعه قطعات الکترونیکی قویتر بسیار مهم است و ذرات فلزی که به این روش رسوب میکنند کاتالیزورهای قدرتمندی برای سنتز شیمیایی و واکنشهای الکتروشیمیایی هستند. علاوه بر این، به دلیل سرعت بالای انتقال پیش ماده در محلول، می توان ذرات با سطح بالا را پوشاند که تحت رسوب بخار شیمیایی در نزدیکی خروجی سیستم تخلیه می شوند و همچنین احتمالاً منجر به ویژگی های رشد سطحی ناپایدار مانند دندریت ها می شود. . نتیجه این است که لایههای بسیار نازک و یکنواختی با سرعت بسیار سریعتر از رسوب لایه اتمی رسوب میشوند که بهترین ابزار دیگر برای پوشش ذرات در این مقیاس است.
خواص ضد میکروبی
CO 2 در فشارهای بالا دارای خواص ضد میکروبی است. در حالی که اثربخشی آن برای کاربردهای مختلف نشان داده شده است، مکانیسمهای غیرفعالسازی به طور کامل شناخته نشدهاند، اگرچه بیش از 60 سال است که مورد بررسی قرار گرفتهاند.
تاریخچه سیال فوق بحرانی
در سال 1822، بارون چارلز کاگنیارد د لا تور، نقطه بحرانی یک ماده را در توپ آزمایشات معروف خود در لوله کشف کرد. او با گوش دادن به ناپیوستگی در صدای یک توپ سنگ چخماق غلتان در یک توپ مهر و موم شده پر از مایعات در دماهای مختلف، دمای بحرانی را مشاهده کرد. بالاتر از این دما، چگالی فازهای مایع و گاز برابر می شود و تمایز بین آنها از بین می رود و در نتیجه یک فاز سیال فوق بحرانی منفرد ایجاد می شود. [43]