- فلوکولانت ها پلیمرهایی با وزن مولکولی بالا بر پایه پلی آکریل آمید هستند
- که در فرآوری معدنی با هدف ایجاد مجموعه ذرات مورد استفاده قرار می گیرند.
- مکانیسم عملکرد فلوکولانت ها بدین صورت است، که گروه های فعال فلوکولانت می توانند روی سطح ذرات جذب شوند
- بدین طریق زنجیر فلوکولانت تعداد زیادی از ذرات را در یک لخته کنار هم نگه می دارد
- مجموعه ذرات ایجاد می شوند.
- مجموعه ذرات به دلیل دارا بودن وزن بیشتر نسبت به ذرات منفرد ته نشینی سریعتری خواهند داشت.
انواع فلوکولانت
- فلوکولانت آنیونی
- فلوکولانت کاتیونی
- فلوکولانت خنثی
کاربرد منعقد کننده ها و فلوکولانت ها
- ذرات محلول و معلق در بیشتر آب های طبیعی وجود دارند.
- این مواد معلق می توانند در اثر سایش زمین، انحلال مواد معدنی ، پوسیدگی گیاهان و دفع نامناسب زباله های خانگی و صنعتی صورت پذیرند.
- در نتیجه وجود مواد معدنی، آلی، ترکیبات بیولوژیکی مانند باکتری ها، ویروس ها و… در آب ها دور از انتظار نیست.
- بیشتر مواد جامد معلق در آب دارای بار منفی هستند. در نتیجه یکدیگر را دفع می کنند
- و این دافعه از جمع شدن ذرات جلوگیری و باعث می شود آنها در حالت تعلیق باقی بمانند.
- انعقاد و لخته سازی در مراحل پی در پی می تواند بر نیروهای تثبیت کننده ذرات معلق غلبه نماید و امکان برخورد ذرات و رشد لخته ها را فراهم کند.
- استفاده از فلوکولانت ها و یا کواگولانت ها برای تصفیه شیمیایی و فیزیکی-شیمیایی آب و پساب به کار برده می شود.
- برای حذف TSS ، TDS ، COD ، BOD و رنگ برای رنج وسیعی از پساب صنایع مختلف مانند نوشیدنی، نساجی، لبنیات ، شوینده ها و … کاربرد دارد و برخلاف تصفیه بیولوژیکی فرآیند پر هزینه ای نیست و نیاز به زمان کمتری برای اثر گذاری دارد.
- این تکنیک معمولا پیش از تصفیه (فیلتراسیون سریع آب ) و یا بعد از ته نشین سازی ابتدایی صورت می پذیرد.
معنای واژه فلوکولانت چیست ؟
فلوکولانت از نظر لغوی به معنای لخته کننده است و کار خود را طی فرآیند فلوکولاسیون یا لخته سازی انجام میدهد. مقصود ما از نوشتن این مقاله بررسی نوع خاصی از Flocculant است که کاربردهای فراوانی در صنایع مختلف دارد. ماهیت این فلوکولانت پلی الکترولیت یا پلی اکریل آمید است که جداسازی جامدات از مایعات را تسریع میکند و تصفیه مایعات را سرعت میبخشد.
شاید ماهیت این ماده شیمیایی برایتان یادآور ماهیت کاتالیزها باشد. اما اگر ابعاد این پرسش که فلوکولانت چیست را تمام و کمال بررسی کنید، خواهید دانست که کارایی فلوکولانت چیزی فراتر از یک کاتالیزور ساده است. میتوان اینگونه استنباط کرد Flocculant خاصیت کلوئیدی نیز دارد، چراکه طی فرآیند فلوکولاسیون، ذرات جامد موجود در مایعات مختلف، به یک دیگر میچسبند و به دلیل قوام به وجود آمده در آنها، آنها در ناحیه مشخصی از مایع مذکور ثابت میمانند. این ناحیه ممکن است متغیر باشد.
حالا احتمالا درک درستی نسبت به فلوکولانت و نحوه عمل آن در فرآیند فلوکولاسیون داشته باشید. Flocculant در صنایع مختلفی از جمله صنایع دارویی و بهداشت، صنایع مرتبط با فراوری معدن ، صنایع مرتبط با زمین شناسی ، صنایع مرتبط با شیمی فیزیک، صنایع مرتبط با تصفیه آب، تست جار و صنایع مرتبط با تولید پنیر کاربرد دارد، که در ادامه به بررسی هر یک از این کاربردها خواهیم پرداخت. ترکیب شیمیایی فلوکولانت به کار رفته در هر یک از صنایع منحصر به فرد است، همین موضوع Flocculant ها را کاربردیتر میکند.
کاربرد فلوکولانت در صنایع
معادن، عمران و علوم زمین شناسی
در اینداستری های درگیر با معدن، عمران و علوم زمین شناسی، فلوکولانت باعث به هم پیوستن رسها، پلیمرها و ذرات کوچک میشود.
در نتیجه این امر ساختاری شکننده در مایعات به وجود میآید که به راحتی میتوان آنها را از مایعات جدا کرد. د
ر این صنایع پس از افزودن، فلوکولانت به مخلوط مورد نظر، به دلیل جاذبهای که بین بارهای مثبت و منفی ذرات به وجود میآید، لخته مورد نظر ایجاد میشود.
در صنایع مرتبط با تغذیه
یکی از کاربردهای فلوکولانت ، مرتبط به صنایع تولید پنیر است، در این صنایع در مراحل مختلف تولید پنیر، برای بررسی میزان پیشرفت پنیر در حال شکل گیری از فلوکولانت استفاده میکنند. فرآیند انعقاد فلوکولانت در کارخانههای تولید پنیر بر اساس، هیدرولیز مولکولها و ماکروپپتیدها شکل میگیرد. از لخته سازها در حین سر و کله زدن با پسابهای ناشی از فعالیت صنایع غذایی نیز استفاده میشود. از جمله لخته کنندههای کاربردی در صنایع غذایی میشود به آهن دو سولفات (FeSO4)، سولفات آلومینیوم و آهن سه کلرید (FeCl3) اشاره کرد.
کاربرد فلوکولانت در علوم و صنایع مرتبط با شیمی و فیزیک
در رابطه با مواد امولوسیون، لخته سازی به فرآیندی اشاره دارد که طی آن مواد ریز معلق در ماده اصلی، به صورت خوشهای به یک دیگر متصل میشوند.
در زیست شناسی و تست جار شیمیایی
از لخته سازی در بیوتکنولوژی برای میکروفیلتراسیون مواد غذایی بیولوژیکی استفاده میشود. لخته کنندههای سلولی عموما بار مثبت دارند ، چراکه بار سلولهای زنده عمدتا مثبت است. هدف از این تست، انتخاب ماده لخته کننده مناسب در انواع واکنشهای شیمیایی است. آزمایش جار شیمیایی به منظور درک فرآیندهای انعقادی، لخته سازی و رسوب گذاری انجام میگیرد. در دستگاه انجام تست جار از مایعاتی که تحت تاثیر مخمر هستند استفاده میشود.
چگونه بهترین فلوکولانت موجود در بازار را بر حسب نیازهایمان انتخاب کنیم؟
- در حقیقت خود این سوال نصف پاسخ را دربردارد، گام اول این است که نیازهایتان را بسنجید.
- از آن جایی که عمده مصرف فلوکولانتها مربوط به تصفیه منابع آبی است، بنابراین تصمیم داریم تا در این مقاله برایتان از خرید فلوکولانت موجود در بازار که توانایی تصفیه آب را داشته باشد، صحبت کنیم.
- فلوکولانت آنیونی بهترین فلوکولانت موجود در بازار برای جداسازی مواد جامد موجود در پساب مورد استفاده قرار می گیرد.
- عملکرد فلوکولانت آنیونی بر پایه ایجاد انواع پیوندهای شیمیایی از جمله پیوند هیدروژنی، پیوند کوالانسی و خواص الکترونگاتیوی مواد شیمیایی انجام میگیرد.
- میزان ضرری که فلوکولانت آنیونی میتواند به بدن انسان و سایر عناصر طبیعی مجاور خود برساند، بسیار کمتر از ضرری است، که فلوکولانتهای کاتیونی به عناصر طبیعی وارد میکنند و شاید بتوان گفت که همین خصوصیات برای اختصاص دادن عنوان بهترین فلوکولانت موجود در بازار به فلوکولانتهای آنیونی کافی باشد. فلوکولانتهای آنیونی انواع مختلفی دارند و شما باید بر حسب نیازتان اقدام به انتخاب فلوکولانت مناسب کنید.
- فلوکولانتهایی که استفاده از آنها برای انسان بیضرر است، عموما حاوی موادی مانند پلی آمید لاتکس، اسید سولفوییک، اسید فسفریک و کربوکسیلیک است، فلوکولانتهای قابل استفاده برای تصفیه پساب به دلیل دارا بودن این ترکیبات عموما وزن مولکولی بالایی دارند. اگر قصدتان خرید فلوکولانت برای لخته سازی مواد در صنایعی به غیر از صنایع تصفیه پساب های صنعتی و معدنی است، دیگر نمیتوان روی فلوکولانتهای آنیونی به عنوان بهترین فلوکولانت موجود حساب کرد.
- برخی اوقات مواد به کار رفته در این لخته کنندهها، حتی توانایی لخته سازی در برخی از مایعات را ندارند و تبدیل به ذرات معلق اضافه میشوند.
انواع فلوکولانت
- فلوکولانت خود به دو دسته ی کلی آلی و معدنی تقسیم می شوند.
- از نمونه های معدنی این لخته ساز ها می توان به ترکیبات آلومینیوم و یا آهن اشاره نمود.
- در سال های اخیر به دلیل اثبات اثرات منفی نوع معدنی این مواد بر سلامتی
- ( به دلیل افزایش یون های معدنی موجود در آب ) از آن ها کمتر استفاده می شود و نوع آلی این مواد جایگزین انواع معدنی گردیده است.
- لخته سازهای پلیمری به طور معمول از هیدروکربن های بلند زنجیر تشکیل شده اند.
- این پلیمر ها شامل چندین واحد تکرار شونده مونومر می باشند و بسته
- به این مونومر ها وزن مولکولی متغیری از 5 تا 20 میلیون دارد.
- وزن مولکولی این مواد به طور قابل توجهی از کواگولانت ها بیشتر است.
- بسته به خواص موجود، این ماده می تواند خنثی، آنیونی و یا کاتیونی باشد.
- ولی در اغلب موارد از نوع خنثی و یا آنیونی برای عملیات تصفیه ی آب استفاده می نمایند.
- فلوکولانت غیر یونی پلیمری بلند زنجیر از پلی اکریل آمید است
- که از مونومر های اکریل آمید ساخته شده است.
- اکثر فلوکولانت های کلیدی در صنعت کوپلیمر های اکریل آمید
- و سدیم اکریلات می باشند. کوپلیمر های اکریل امید-اکریلات
- به علت وجود گروه های کربوکسیلات با بار های منفی در پلیمر ،آنیونی می باشند.
- نسبت اکریلات سدیم به اکریل امید مقدار آنیونی بودن آن را تعیین می کند
- . افزایش مقدار سدیم اکریلات موجب به وجود امدن فولوکولانت با شارژ منفی بیشتر می شود .
چرا از فلوکولانت استفاده میکنیم
- فلوکولانت ها به طور گسترده ای به همراه منعقد کننده ها برای افزایش بازدهی فرایند
- انعقاد و لخته سازی و یا به طور مستقیم و بدون استفاده
- از منعقدکننده ها و برای حذف ذرات کلوئیدی از پساب استفاده میشوند.
- لختهسازهایی که بیشتر از همه مورد استفاده قرار میگیرند سنتزی هستند.
- طبق پژوهشهای پیشین عموما منعقدکنندههای معدنی (نمک های فلزی)
- مثل آلوم و کلرید آهن نیازی به استفاده از لختهسازها ندارند.
- پلیمرهای مصنوعی که معمولاً برای شفاف سازی آب مورد استفاده قرار می گیرند معمولا ترکیباتی مانند پلی آکریل آمید ،
- پلی آکریلیک اسید ، اسید پلی استایرنیک سولفونیک و پلی دی آلیل دی میتل آمونیوم کلرید (DADMAC) می باشند.
- تعداد بسیار زیادی فلوکولانت آلی وجود دارند که بیشتر آنها سنتزی هستند
- و شامل پلیآکریلآمید ها، پلیآکریلیک اسیدها، اسید های سولفونیک پلیاستایرن و مشتقات آن ها میشوند.
- این لخته ساز ها عموماً پلیمرهای حلال در آب و خطی هستند
- که واحد های بیشماری از مونومرها در آنها تکرار شده است،
- وزن مولکولی بالایی دارند و میتوانند یونی (پلی الکترولیتی) یا غیر یونی باشند.
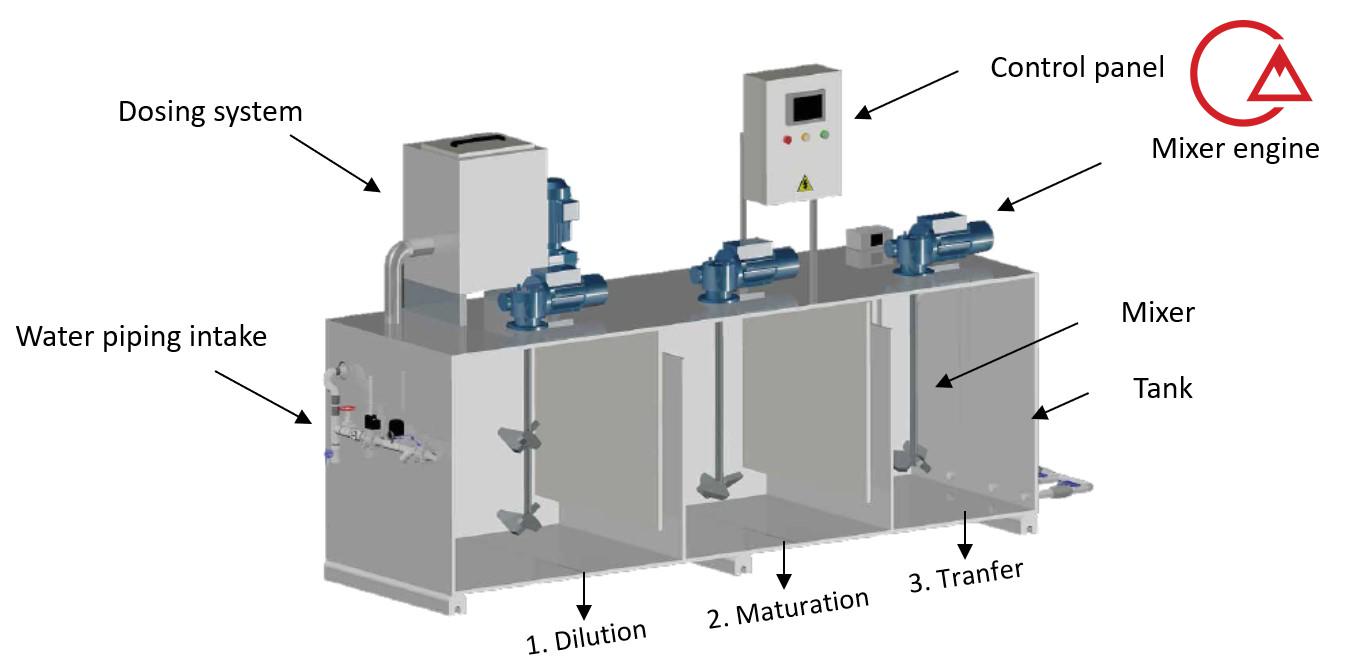
فرایند فلوکولاسیون و نقش فلوکولانت در آن
- کواگولانت به آب افزوده می شود تا ذرات معلق موجود در آب مانند خاک رس و مواد آلی را خنثی نماید. پ
- س از عملیات خنثی سازی ذرات معلق به یکدیگر می چسبند و میکروفلوک ها را تشکیل می دهند.
- با این حال این ذرات همچنان برای دیده شدن با چشم مسلح بسیار کوچک می باشند.
- باید توجه نمود که اختلاط بیش از حد بر انعقاد تأثیر نمی گذارد ،
- اما عدم اختلاط کافی این مرحله را ناقص می کند. این مرحله rapid-mix
- (مخلوط سریع) نامیده می شود و معمولا 1 الی 3 دقیقه به طول می انجامد.
- سپس در طی فرایند فلوکولاسیون ذرات درشت تر و قابل مشاهده می شوند.
- به این مرحله slow mixing مخلوط آهسته گفته می شود.
- برخورد ذرات موجب می شود تا ترکیبات درشت تری به وجود آید و ماکروفلوک ها به وجود آیند.
- پلیمرهای با وزن مولکولی بالا (کمک منعقد کننده ها ) در این مرحله می توانند به محلول اضافه شوند تا به برقراری پل ، اتصال و تقویت ذرات ، افزایش وزن و افزایش سرعت کمک نمایند.
- در نهایت پس از رسیدن ذرات به اندازه و مقاومت بهینه ، آب برای فرآیند جداسازی (رسوب ، شناور سازی یا تصفیه) آماده می شود.
- زمان تماس برای لخته سازی از 15 یا 20 دقیقه تا یک ساعت یا بیشتر برآورد می شود.
استفاده از فلوکولانت برای شفاف کردن آب استخر ها
بله اگر آب استخر شما کدر شده باشد می توانید از این مواد برای تمیز سازی آن استفاده کنید. مقدار مورد استفاده از این ترکیب به منظور تمیز سازی به موارد زیادی از جمله حجم آب ، تعادل pH ، دمای استخر و مارک خاص فلوکولانت مورد استفاده ی شما بستگی دارد. مقدار بیش از حد از این ماده می تواند به پوست شما آسیب وارد کند و واکنش های شدیدی را با سایر مواد شیمیایی موجود در آب استخر در پی داشته باشند. پیش از آنکه فلوکولانت مورد نظر را به آب اضافه کنید لازم است تا موارد زیر را رعایت نمایید:
- به دلیل از دست رفتن اب در طی فرایند فلوکولاسیون، لازم است تا سطح آب را به بالاترین میزان ممکن افزایش دهید.
- از آنجایی که این ترکیبات می توانند میزان pH را تحت تاثیر قرار دهند لازم است تا برای شروع حتما سطح pH آب را به حدود 7 برسانید
- طبق دستوالعمل مندرج بر روی محصول لازم است تا حتما لخت ساز های مورد استفاده را رقیق نمایید.
- این ماده را به صورت رقیق شده بر لبه های استخر اعمال کنید.
- پمپ استخر را برای چندین ساعت فعال نمایید تا ماده ی مورد نظر به صورت یکنواخت به آب استخر اعمال شود
- پمپ را خاموش کنید و به مدت 8 ساعت زمان دهید تا آلاینده ها ته نشین شوند.
- فیلتر را فعال نمایید
- پمپ را روشن کنید، بعد از گذشت 8 ساعت ، رسوبات را در پایین استخر خود مشاهده خواهید کرد
- آب استخر را خالی و تعویض کنید.
- فیلترهای استخر را به خوبی شستشو دهید تا همه رسوبات و مواد شیمیایی باقیمانده در آنها جمع آوری شود.
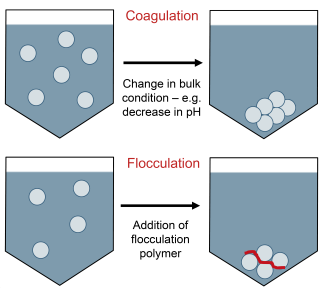
انعقاد و لخته سازی در تصفیه آب چیست؟
انعقاد و لخته سازی اجزای ضروری تصفیه آب آشامیدنی و فاضلاب هستند . آنها یک فرآیند قابل اعتماد برای درمان کدورت آب (کدری یا تیرگی یک مایع که معمولاً با چشم غیرمسلح نامرئی است) ارائه می دهند که یک آزمایش کلیدی برای کیفیت آب است. در تصفیه فاضلاب، آنها را تا 90٪ کاهش در مواد جامد معلق و بارهای آلی امکان پذیر می کند.
تمام آب ها حاوی ذرات معلق هستند. کوچکترین ذرات (کلوئیدها) در اثر اعمال نیروهای فیزیکی (الکتریسیته ساکن) بر روی خود ذرات تثبیت می شوند و به دلیل اینکه همه آنها وقتی در آب معلق می شوند بار منفی دارند، یکدیگر را دفع می کنند. این باعث می شود که آنها به جای اینکه روی هم جمع شوند و خارج از آب مستقر شوند معلق بمانند. ممکن است روزها یا حتی قرن ها طول بکشد تا ساکن شوند!
انعقاد و لخته سازی دو فرآیند جداگانه هستند که به صورت متوالی برای غلبه بر نیروهای تثبیت کننده ذرات معلق استفاده می شوند. در حالی که انعقاد بارهای روی ذرات را خنثی می کند، لخته سازی آنها را قادر می سازد به یکدیگر متصل شوند و آنها را بزرگتر کند تا راحتتر از مایع جدا شوند.
فرآیند انعقاد در تصفیه آب
این فرآیندی را که به موجب آن ذرات کوچک یکدیگر را دفع میکنند، از بین میبرد و باعث تثبیت آنها به ذرات بزرگتر میشود که میتوانند به هم بچسبند. هر چه ذره بزرگتر باشد، راحت تر از مایع جدا می شود. استفاده از مواد منعقد کننده برای تصفیه آب به حدود 2000 سال قبل از میلاد مسیح باز می گردد، زمانی که مصریان از بادام که در اطراف ظروف آغشته شده بود برای تصفیه آب رودخانه استفاده می کردند.
این تودههای بزرگتر ذرات میکرو لخته نامیده میشوند و هنوز هم همیشه با چشم غیر مسلح دیده نمیشوند. آب اطراف این ذرات تازه تشکیل شده باید شفاف باشد – و این نشان می دهد که بارهای ذرات خنثی شده اند. اگر اینطور نیست، ممکن است به منعقد کننده بیشتری نیاز باشد. مقدار بیش از حد منعقد کننده و ذرات به دفع یکدیگر باز می گردند – اما عمدتاً توسط بار معکوس.
اختلاط سریع باعث می شود که منعقد کننده به درستی پراکنده شود تا برخورد ذرات را افزایش دهد. محصولات هیدرولیز منعقد کننده فلزی که در عرض 0.01 تا 1.0 ثانیه تشکیل می شوند، برای بی ثباتی موثرترین هستند – به همین دلیل است که تنظیم pH و پس از دوز منعقد کننده بیشتر به ندرت پس از افزودن منعقد کننده اولیه مؤثر است.
یکی از انواع متداول میکسرهای سریع، راکتور پس اختلاط نامیده می شود که معمولاً از مخازن مربعی با پروانه های عمودی تشکیل شده است. در بسیاری از موارد، آنها نتایج ضعیفی تولید می کنند، و WCS تمایل به طراحی میکسرهای درون خطی با کنترل گرادیان سرعت دارد تا بهترین شرایط را برای اختلاط سریع فراهم کند.
انواع مواد منعقد کننده
امروزه دو نوع منعقد کننده وجود دارد که بیشتر در تصفیه آب و فاضلاب استفاده می شود. آلی و معدنی.
منعقد کننده های غیر آلی عبارتند از:
- منعقد کننده های آلومینیوم – به عنوان مثال سولفات آلومینیوم، کلرید آلومینیوم و آلومینات سدیم
- منعقد کننده های آهن – به عنوان مثال سولفات آهن، سولفات آهن، کلرید آهن و سولفات کلرید آهن
انعقادگران آلی عبارتند از:
- پلی آمین ها
- پلی دی آلیل دی متیل آمونیوم کلرید (Poly DADMACs)
- پلی تنات
منعقد کننده های غیر آلی
ثابت شده است که هر دو منعقد کننده آلومینیوم و آهن در از بین بردن بیشتر مواد جامد معلق بسیار موثر هستند. آنها تعدادی مزیت را ارائه می دهند:
- یونهای باردار را فعال کنید تا چگالی بار بالایی برای خنثی کردن ذرات معلق ایجاد کنند، که به هیدروکسیدهای معدنی هیدراته اجازه میدهد تا زنجیرههای پلیمری کوتاهی ایجاد کنند که تشکیل میکروفلوک و لختههای سنگین را افزایش میدهد.
- قادر به حذف بخشی از پیش سازهای آلی است که ممکن است با کلر ترکیب شود و محصولات جانبی ضد عفونی را تشکیل دهد.
- هزینه واحد پایین و در دسترس بودن گسترده
آنها معایبی دارند:
- آنها حجم زیادی از لخته، غنی از فلز را ایجاد می کنند که باید به روشی مناسب از نظر زیست محیطی دفع شوند، که می تواند هزینه قابل توجهی را برای دفع بیافزاید.
- آنها می توانند به طور قابل توجهی PH آب را تغییر دهند، جایی که pH برای انعقاد موثر حیاتی است و نیاز به کنترل pH دارد. آنها همچنین به تجهیزات ذخیره سازی و تغذیه مقاوم در برابر خوردگی نیاز دارند.
- سولفات و کلرید آلومینیوم، سولفات آهن و کلرید و سولفات آهن بسیار اسیدی هستند، قلیاییت را از بین می برند و pH را پایین می آورند. از طرف دیگر آلومینات سدیم باعث افزایش قلیایی و افزایش pH می شود.
منعقد کننده های آلی
ثابت شده است که هر دو منعقد کننده پلی آمین و پلی DADMAC در از بین بردن اکثر جامدات معلق بسیار موثر هستند. تانن ها به ویژه در روغن ها و چربی ها مفید هستند. آنها تعدادی مزیت را ارائه می دهند:
- برای خنثی کردن ذرات معلق با بار پایین تر، چگالی نسبتا کم بار را فعال کنید. زنجیره های پلیمری طولانی تری تولید کنید که تشکیل میکروفلوک را بدون فلزات یا هیدروکسیدها افزایش می دهد
- قادر به حذف بخشی از پیش سازهای آلی است که ممکن است با کلر ترکیب شود و محصولات جانبی ضد عفونی را تشکیل دهد.
- حجم لخته کوچک تولید کنید
- فرم های مایع، غیر خورنده، آماده برای استفاده مستقیم.
- تاثیری ندارند و به ندرت یا به طور جزئی تحت تاثیر pH قرار می گیرند
آنها معایبی دارند:
- هزینه واحد بالاتر
- اگر تقاضای شارژ زیاد باشد، به دوزهای بالا نیاز است
- لخته با چگالی کم – همیشه خوب ته نشین نمی شود.
متداول ترین منعقد کننده های شیمیایی معدنی در تصفیه آب
سولفات آلومینیوم رایج ترین ماده شیمیایی مورد استفاده برای انعقاد در تصفیه فاضلاب است . منعقد کننده های دیگر که معمولاً مورد استفاده قرار می گیرند عبارتند از سدیم آلومینات، سولفات آهن و کلرید آهن.
سولفات آلومینیوم
سولفات آلومینیوم پرمصرف ترین منعقد کننده آلومینیوم است. این در تعدادی از اشکال جامد مانند بلوک، کیبله، یا زمین موجود است و همچنین به عنوان محلول موجود است. هنگامی که به آب اضافه می شود، منعقد کننده اسیدی و قلیاییت طبیعی آب واکنش نشان می دهد و یک لخته هیدروکسید آلومینیوم را تشکیل می دهد که معمولاً از بی کربنات کلسیم تشکیل شده است. کنترل pH در انعقاد، هم برای حذف کدورت و رنگ و هم برای حفظ حداقل سطح رضایت بخش آلومینیوم باقی مانده در آب زلال شده مهم است.
سدیم آلومینات
آلومینات سدیم از ترکیب اکسید سدیم و اکسید آلومینیوم تشکیل می شود. اشکال جامد این ماده شیمیایی معمولاً حاوی 70 تا 80 درصد آلومینات سدیم است، در حالی که اشکال مایع حاوی حدود 30 درصد آلومینات سدیم است. به دلیل وزن مولکولی کم AI، محلول های آلومینات سدیم تولید لجن شیمیایی را در مقایسه با آهن کاهش می دهد. علاوه بر این، آلومینات ها قلیایی بودن آب را افزایش می دهند و نیاز به آهک یا هیدروکسیدها را از بین می برند.
سولفات فریک
سولفات فریک نوعی منعقد کننده آهن است که اغلب همراه با کلر استفاده می شود و می تواند لخته متراکم تری نسبت به سولفات آلومینیوم ایجاد کند. در مقایسه با آلوم، سولفات آهن دارای مزایایی است. به عنوان مثال، ذرات گله هیدروکسیدهای آهن دارای چگالی بالاتری نسبت به گله های آلوم هستند و با ته نشینی راحت تر حذف می شوند. با این حال، معایبی نیز دارد زیرا لجن هیدروکسید بسیار سنگینتری تولید میکند و حل شدن آن دشوار است.
کلرید آهن
کلرید فریک به عنوان لخته کننده و منعقد کننده عمل می کند. در صنعت تصفیه آب همه کاره است و جایگزینی برای سولفات آهن است. به طور کلی باعث رسوب سریعتر می شود، به خصوص در آب سرد. با این حال، این انتخاب کمتر محبوب است، زیرا کلرید می تواند خورندگی آب را افزایش دهد.
کدام ماده منعقد کننده را برای تصفیه آب انتخاب کنید؟
در تصفیه آب معمولاً از منعقد کننده های فلزی مانند موارد ذکر شده در بالا استفاده می شود. در دسترس بودن و مقرون به صرفه بودن، ملاحظات کلیدی هستند که عموماً بر منعقد کننده مورد استفاده تأثیر می گذارند. سولفات آلومینیوم معمولاً در دسترس و مقرون به صرفه است و همچنین بسیار مؤثر است.
با این حال، انواع دیگری از منعقد کننده ها نیز در دسترس هستند:
- منعقد کننده های مصنوعی ممکن است چگالی بار بالایی روی مولکول های نسبتا بزرگ داشته باشند. بسته به نحوه ساخت آنها، برخی از مشتقات مصنوعی ممکن است به عنوان یک لخته ساز عمل کنند.
- منعقد کننده های بیوپلیمری از منابع طبیعی (مانند قارچ ها و منابع گیاهی). به طور کلی، اینها لجن کمتری تولید می کنند، سمی کمتری دارند و ایمن تر هستند.
لخته سازی در تصفیه فاضلاب چیست؟
پس از انعقاد (“خنثی سازی بار”)، فرآیند دوم به نام لخته سازی باید انجام شود. این رشد ذرات کوچک و خنثی به ذرات بزرگتر است. فلوکولانت ها عواملی هستند که این تجمع ذرات ریز را به “لخته” افزایش می دهند که می تواند به راحتی از آب جدا شود. آنها همیشه پلیمر هستند.
فرآیند لخته سازی یک مرحله اختلاط ملایم است که اندازه ذرات را از میکرو لخته به ذرات معلق بزرگ و قابل رویت به نام پین لخته افزایش می دهد. برخوردهای اضافی بین پین-لخته ها باعث می شود که آنها حتی بزرگتر، “لخته های ماکرو” تولید کنند. لختهسازها به این امر کمک میکنند که پلیمرهای با زنجیره بلند با بار کم برای درهمتنیدگی، افزایش نیروهای واندروال و پیوند هیدروژنی بین ذرات هستند. هنگامی که این لخته ها به اندازه و قدرت بهینه رسیدند، آب برای جداسازی جامد-مایع آماده می شود. این می تواند فیلتراسیون، سانتریفیوژ، ته نشینی یا فلوتاسیون باشد.
نقش پلیمرها در لخته سازی
پلیمرها طیفی از ترکیبات درشت مولکولی محلول در آب هستند که توانایی تثبیت یا افزایش لخته سازی اجزای تشکیل دهنده را در بدنه آب دارند. آنها به عنوان بخشی از فرآیند لخته سازی برای کمک به تقویت و افزایش وزن ته نشینی لخته اضافه می شوند.
پلیمرها می توانند طبیعی یا مصنوعی باشند. قدمت پلیمرهای طبیعی نیز به دوران باستان بازمیگردد، در ادبیات سانسکریت از حدود 2000 قبل از میلاد به استفاده از آجیل خرد شده برای شفافسازی آب اشاره شده است. پلیمرهای طبیعی عملاً عاری از سموم هستند و زیست تخریب پذیر هستند. پلیمرهای مصنوعی بیشتر مورد استفاده قرار می گیرند زیرا موثرتر، قابل اعتمادتر، تکرارپذیرتر و مقرون به صرفه هستند.
فرآیند انعقاد و لخته سازی در تصفیه فاضلاب چه چیزی را حذف می کند؟
انعقاد و لخته سازی تعداد زیادی از ترکیبات آلی و همچنین ذرات معلق از جمله رسوبات معدنی را حذف می کند. این فرآیند ذرات و مواد محلول را حذف می کند. با این حال، آب ممکن است همچنان حاوی عوامل بیماری زا، از جمله ویروس ها و باکتری ها باشد. پاتوژن ها معمولاً تنها در صورتی حذف می شوند که به مواد محلول که توسط انعقاد و لخته سازی حذف می شوند، چسبیده باشند.
این اولین گام در تصفیه فاضلاب و تبدیل آن به آب آشامیدنی است – انعقاد و لخته سازی بسیاری از ذراتی را که ضدعفونی کردن آب را پیچیده می کند، حذف می کند. به لطف انعقاد و لخته سازی، مقدار کمتری کلر برای ضد عفونی کردن آب باید اضافه شود. و استفاده کمتر از کلر باعث صرفه جویی در هزینه و ایمن تر شدن آب می شود.
نتیجه
انعقاد و لخته سازی دو بخش جداگانه و حیاتی تصفیه آب و فاضلاب هستند. انعقاد ذرات معلق ریز را با خنثی سازی بار استاتیکی ناپایدار می کند، در حالی که لخته سازی به آنها کمک می کند تا به یکدیگر متصل شوند تا مورفولوژی های بسیار بزرگتری تشکیل دهند، بنابراین می توان آنها را راحت تر از فاز مایع جدا کرد.
در گروه WCS، طیف منعقدکنندهها و لختهسازهای خاص انتخابشده ما میتوانند به میزان قابل توجهی تولید لجن را کاهش دهند و مسیرهای یکبار مصرف جایگزین یا گزینههای جدید فاضلاب را برای مشتریان خود ایجاد کنند. برای کسب اطلاعات بیشتر، تماس بگیرید.
در نهایت، اگر تعهدات زیستمحیطی تصفیه فاضلاب انجام نشود، بررسیهای زیستمحیطی فزاینده و خطرات اعتباری عمده وجود دارد. خرید یک سیستم تصفیه فاضلاب ممکن است از نظر اقتصادی مقرون به صرفه نباشد. با این حال، استخدام یک گزینه قبل از ایجاد پرونده برای وجوه سرمایه است.
موضوعات: فاضلاب
تفاوت بین انعقاد و لخته سازی
تفاوت اصلی – انعقاد در مقابل لخته سازی
انعقاد و لخته سازی دو فرآیندی هستند که معمولاً در تصفیه آب به منظور خلاص شدن از شر مواد معلق ناخواسته در آب استفاده می شوند. با این حال، آنها را می توان به طور معمول برای بی ثبات کردن هر سیستم تعلیق استفاده کرد. انعقاد شامل استفاده از یک منعقد کننده است که پتانسیل آن را دارد که ذرات باردار تثبیت شده قبلی در سوسپانسیون را از بین ببرد. در مقابل، در لخته سازی، بی ثباتی با تکنیک های فیزیکی مانند مخلوط کردن محلول و همچنین گاهی اوقات با افزودن پلیمرها ایجاد می شود. این تفاوت اصلی بین انعقاد و لخته سازی است.
1. سوسپانسیون کلوئیدی چیست؟
– تعریف، ویژگی ها، فرآیند
2. انعقاد چیست
– تعریف، کاربرد
3. فلوکولاسیون چیست؟
– تعریف، کاربرد
4. تفاوت انعقاد و لخته سازی چیست؟
سوسپانسیون کلوئیدی چیست؟
تعلیق با محلول متفاوت است زیرا فاز پیوسته ندارد. محلول زمانی ساخته می شود که یک املاح به طور کامل در یک حلال حل شود و به یک فاز پیوسته تبدیل شود. اما یک سوسپانسیون یک فاز پراکنده در فاز پیوسته را در خود جای می دهد و فاز پراکنده عموماً از ذرات میکروسکوپی ساخته شده است که در فاز پیوسته محلول نیستند. به این معنی که این ذرات نباید ته نشین شوند یا باید مدت زمان زیادی طول بکشد تا ته نشین شوند. ماده پراکنده معمولاً به عنوان “کلوئید” نامیده می شود و سوسپانسیون به عنوان یک سوسپانسیون کلوئیدی شناخته می شود.
یک سوسپانسیون کلوئیدی را می توان با کنار هم قرار دادن کلوئیدها تجزیه کرد. همانطور که در بالا ذکر شد، انعقاد و لخته سازی دو رویکرد متفاوت برای دستیابی به این امر هستند. انعقاد شامل استفاده از یک منعقد کننده است که پتانسیل آن را دارد که ذرات باردار تثبیت شده قبلی در سوسپانسیون را از بین ببرد. در حالی که در لخته سازی، بی ثباتی با تکنیک های فیزیکی مانند مخلوط کردن محلول و همچنین گاهی اوقات با افزودن پلیمرها ایجاد می شود.
انعقاد چیست
همانطور که در بالا ذکر شد، انعقاد یک فرآیند شیمیایی است که در آن شیمی سوسپانسیون باید تغییر کند تا باعث ته نشین شدن ذرات شود. بنابراین نیاز به افزودن یک منعقد کننده دارد. ماده منعقد کننده با ذرات یا کلوئیدهای موجود در سوسپانسیون واکنش می دهد و بار شیمیایی آن را نامتعادل می کند. یکی از رایج ترین منعقد کننده های مورد استفاده آلوم است (Al 2 (SO 4 ) 3 .14H 2 O).
انعقاد یک پدیده مهم در لخته شدن خون است. از این رو، انعقاد معمولاً به عنوان لخته شدن شناخته می شود. اثرات یک ماده منعقد کننده را می توان با استفاده از یک ضد انعقاد معکوس کرد. این ضد انعقادها اغلب برای کاهش لخته شدن خون برای جلوگیری از انسداد شریان استفاده می شوند.

آلوم ویلته
فلوکولاسیون چیست؟
در لخته سازی، بی ثباتی سوسپانسیون کم و بیش نتیجه فرآیندهای فیزیکی است تا شیمیایی. متداول ترین راه افزودن یک لخته ساز به سوسپانسیون است، جایی که لخته ساز عموماً پلیمری است. پلیمر سپس پایه ای را برای ته نشین شدن ذرات فراهم می کند و در نهایت تبدیل به یک لخته یا پوسته می شود که ذرات را به خارج از سوسپانسیون جذب می کند. بنابراین، لخته سازی تکنیکی است که باعث تجمع ذرات می شود. انباشتگی به عنوان “فرآیندی که در آن مجموعه ها به منظور بی ثبات کردن تعلیق ها تشکیل می شوند” تعریف می شود.
انباشتگی همچنین می تواند از طریق فرآیندهای لخته سازی که در آن تکنیک های فیزیکی خاصی مانند اختلاط سوسپانسیون درگیر هستند، ایجاد شود. علاوه بر این، سرعت اختلاط، زمان اختلاط و غیره می تواند بر کارایی فرآیند لخته سازی تأثیر بگذارد.
تفاوت بین انعقاد و لخته سازی
نوع فرآیند
انعقاد: انعقاد یک فرآیند شیمیایی است.
لخته سازی: لخته سازی یک فرآیند فیزیکی است.
انعقاد در مقابل فلوکولانت
انعقاد: ماده منعقد کننده اغلب نمک است و برای آزاد کردن بارها تجزیه می شود.
: فلوکولانت اغلب پلیمری است که باعث ته نشین شدن ذرات می شود و در نهایت به پوسته های بزرگتر تبدیل می شود.
تکنیک
انعقاد: انعقاد صرفاً یک واکنش شیمیایی است.
لخته سازی: فرآیندهای فیزیکی مانند اختلاط به عنوان یک تکنیک در لخته سازی استفاده می شود.
تفاوت بین انعقاد و لخته سازی در تصفیه آب
تفاوت کلیدی – انعقاد مقابل لخته سازی در تصفیه آب
تصفیه آب یک جنبه مهم است که مراحل مختلفی را شامل می شود. از آنجایی که تصفیه آب یک فرآیند بسیار حساس و مهم است، نیاز به حضور هر دو فرآیند فیزیکی و شیمیایی دارد. بازیابی کیفیت آب در طول تصفیه آب تضمین می شود. مراحل انعقاد و لخته سازی جنبه های مهمی در زمینه تصفیه آب هستند زیرا امکان جداسازی موثر ذرات معلق موجود در آب را فراهم می کند. در انعقاد، فرآیند شامل استفاده از یک منعقد کننده است که توانایی بی ثبات کردن ذرات باردار غیرقابل ته نشینی را دارد در حالی که لخته سازی شامل فرآیند بی ثباتی مشابهی است که از طریق اختلاط فیزیکی و با افزودن پلیمرهای . تفاوت اصلی بین انعقاد و لخته سازی در تصفیه آب این است که انعقاد یک فرآیند شیمیایی است در حالی که لخته سازی یک فرآیند فیزیکی است.
فهرست
1. بررسی اجمالی و تفاوت کلیدی
2. انعقاد در تصفیه آب چیست؟
3. لخته سازی در تصفیه آب چیست؟
4. شباهت های بین انعقاد و لخته سازی در تصفیه آب
5. مقایسه کنار هم – انعقاد در مقابل لخته سازی در تصفیه آب به صورت جدولی
6. خلاصه
انعقاد چیست؟
انعقاد به زبان ساده به لخته شدن یا لخته شدن گفته می شود. از جنبه شیمیایی، می توان آن را به عنوان فرآیندی توضیح داد که توسط آن بارهای ذرات که در حال ته نشین شدن نیستند، بی ثبات می کند. این یک مرحله مهم در بسیاری از فرآیندهای مختلف بیوشیمیایی است. با این حال، انعقاد عمدتا در طول روش های تصفیه آب استفاده می شود. انعقاد را می توان به سادگی با افزودن یک ماده منعقد کننده به محیط بدست آورد. این باعث جمع شدن ذرات می شود. در رابطه با شیمی این روش، افزودن یک منعقد کننده بارهای ذره را بی ثبات می کند. این با افزودن یک منعقد کننده که دارای بار مخالف با مواد جامد معلق است به دست می آید.
این باعث خنثی شدن بار ذرات مختلف غیر قابل ته نشین می شود که شامل خاک رس و سایر مواد آلی معلق در آب است که باعث افزایش کدورت آب می شود. منعقد کننده ها شامل نمک های معدنی آلومینیوم یا آهن هستند. به عنوان مثال می توان به سولفات آلومینیوم، کلرید آلومینیوم، آلوم و سولفات آهن اشاره کرد. این نمک ها توانایی هیدرولیز ذرات به رسوبات نامحلول را دارند که ذرات را در کنار هم به دام می اندازد.
شکل 01: انعقاد در تصفیه آب
هنگامی که مواد منعقد کننده اضافه می شوند و بارهای ذرات خنثی می شوند، به ذرات اجازه می دهد تا با یکدیگر تعامل کنند و به هم بچسبند. به این ذرات به هم پیوسته میکروفلوک گفته می شود. اما این ذرات با چشم غیر مسلح قابل مشاهده نیستند. این مرحله با لخته سازی دنبال می شود.
فلوکولاسیون چیست؟
لخته سازی شامل تشکیل لخته است. این امر عمدتاً از طریق فرآیند فیزیکی و مکانیکی حاصل می شود فلوکولانت که درگیر توده های منعقد شده برای پیوستن به یکدیگر است. این منجر به تشکیل توده های بزرگی از لخته ها می شود که در ابتدا به صورت ابر ظاهر می شوند و سپس به رسوب تبدیل می شوند. لخته سازی یک مرحله مهم در روش های تصفیه آب است که همیشه مرحله انعقاد را دنبال می کند.
در طی فرآیند لخته سازی، محلولی که قبلاً منعقد شده است به آرامی مخلوط می شود. این اجازه می دهد تا اندازه توده های منعقد شده که میکروفلوک های زیر میکروسکوپی هستند تا مرحله ای افزایش یابد که به صورت ذرات معلق قابل مشاهده ظاهر شوند. بنابراین، توده های بزرگ یا رسوب بزرگ را می توان به راحتی جدا کرد و از محیط خارج کرد. فرآیند اختلاط آهسته لخته سازی امکان تماس میکروفلوک ها با یکدیگر را فراهم می کند که باعث ایجاد برخورد بین میکروفلوک می شود.
این برخوردها باعث ایجاد پیوند بین میکروفلوک ها می شود و منجر به تشکیل ذرات بزرگتر می شود که قابل مشاهده هستند. با ادامه اختلاط، اندازه لخته به تدریج افزایش می یابد. این فرآیند با افزودن پلیمرهای آلی که وزن مولکولی بالایی دارند، کمک میکند. به این مواد کمکی انعقادی نیز می گویند. افزودن پلیمرهای آلی منجر به جنبه های مختلفی می شود. این امکان پل زدن و تقویت لخته را فراهم می کند که باعث افزایش وزن لخته و همچنین افزایش سرعت ته نشینی می شود.
شکل 02: فرآیند تصفیه آب آشامیدنی
زمانی که لخته به قدرت و اندازه مطلوب خود رسید، لخته سازی کامل می شود. این معمولاً بسته به اندازه محیط یک ساعت طول می کشد. پس از تکمیل لخته سازی، آب واجد شرایط برای انجام فرآیندهای جداسازی است.
شباهت های بین انعقاد و لخته سازی در تصفیه آب چیست؟
- انعقاد و لخته سازی دو مرحله اصلی و مهم در تصفیه آب آشامیدنی و فاضلاب هستند.
- هر دو فرآیند شامل اتحاد ذرات معلق مختلف با هم هستند.
تفاوت بین انعقاد و لخته سازی در تصفیه آب چیست؟
انعقاد در مقابل لخته سازی در تصفیه آب | |
| انعقاد یک مرحله مهم در تصفیه آب است و شامل افزودن یک منعقد کننده برای افزایش لخته شدن ذرات معلق در آب است. | لخته سازی مرحله مهم دیگری در تصفیه آب است و شامل تشکیل لخته های قابل مشاهده با اختلاط مکانیکی یا فیزیکی است. |
| نوع فرآیند | |
| انعقاد یک فرآیند شیمیایی است. | لخته سازی یک فرآیند فیزیکی است. |
| ترکیبات اضافه شده | |
| مواد منعقد کننده مانند نمک های معدنی آلومینیوم یا آهن که ذرات معلق را خنثی می کنند فلوکولانت در طول انعقاد اضافه می شوند. | فلوکولانت مانند یک پلیمر آلی که در پل زدن و تقویت لخته ها نقش دارد اضافه می شود. همچنین باعث افزایش وزن لخته ها و افزایش سرعت ته نشینی می شود. |
| اختلاط فیزیکی | |
| انعقاد شامل فرآیند اختلاط فیزیکی نیست. | لخته سازی شامل اختلاط فیزیکی است. |
خلاصه – انعقاد مقابل لخته سازی در تصفیه آب
تصفیه آب یک فرآیند بسیار حساس و مهم است. به حضور هر دو فرآیند فیزیکی و شیمیایی نیاز دارد. مراحل انعقاد و لخته سازی جنبه های مهمی در زمینه تصفیه آب آشامیدنی و فاضلاب هستند زیرا امکان جداسازی موثر ذرات معلق موجود در آب را فراهم می کند. انعقاد یک فرآیند شیمیایی است و لخته سازی یک فرآیند فیزیکی است، در انعقاد، این فرآیند شامل استفاده از یک منعقد کننده است که توانایی بی ثبات کردن ذرات باردار غیرقابل ته نشینی را دارد، در حالی که لخته سازی شامل یک فرآیند بی ثبات سازی مشابه است که از طریق اختلاط فیزیکی به دست می آید و با افزودن پلیمرهای آلی این تفاوت بین انعقاد و لخته سازی است.
دانلود نسخه PDF انعقاد در مقابل لخته سازی در تصفیه آب
میتوانید نسخه PDF این مقاله را دانلود کنید و طبق یادداشت استنادی از آن برای اهداف آفلاین استفاده کنید. لطفا نسخه PDF را از اینجا دانلود کنید تفاوت بین انعقاد و لخته سازی در تصفیه آب
ارجاع
1. “لخته و منعقد کننده”. ChemTreat. در اینجا موجود است
2. “انعقاد – لخته سازی.” انعقاد-لخته سازی | SSWM. در اینجا موجود است
فلوکولانت به تصویر:
1. فرآیندهای انعقاد و فیلتراسیون در یک تصفیه خانه آب آشامیدنی. (14868618507)’ توسط USEPA Environmental-Protection-Agency. (دامنه عمومی) از طریق Wikimedia Commons
2. “تصویر فرآیند تصفیه آب آشامیدنی معمولی” توسط بنیاد CK-12، (CC BY-SA 3.0) از طریق ویکیمدیا مشترک
انعقاد فلوکولانت و لخته سازی
استفاده از انعقاد و لخته سازی در تصفیه فاضلاب
در مورد انعقاد و لخته سازی
تعریف انعقاد و لخته سازی در سراسر صنعت یکسان نیست و برای جلوگیری از هرگونه سوء تفاهم، اصطلاحات را به این صورت تعریف می کنیم:
انعقاد: ذراتی که به عنوان مثال با تأثیر تغییر در pH با خود جمع می شوند.
لخته سازی: ذراتی که با استفاده از پلیمرهایی که آنها را به یکدیگر متصل می کند، تجمع می یابند.
انعقاد و لخته سازی تکنیک های شناخته شده در تصفیه فاضلاب هستند. آنها معمولاً برای تصفیه فاضلاب فلوکولانت حاوی کلوئید (ذرات معلق) و یون های فلزی استفاده می شوند. اما این پدیده ها از زندگی روزمره نیز به خوبی شناخته شده اند – به ویژه انعقاد.
یک مثال خوب شیر ترش است. وقتی شیر ترش می شود PH کاهش می یابد که باعث می شود ذرات چربی بی ثبات شده و سپس منعقد شوند.
تصفیه فاضلاب صنعتی
استفاده متداول از انعقاد و لخته سازی برای تصفیه فاضلاب در صنعت گالوانیکی است. اکثر شرکت های گالوانو فاضلاب حاوی یون های فلزی تولید می کنند. با استفاده از انعقاد و لخته سازی می توان این یون ها را رسوب داد و در یک مخزن ته نشینی ته نشین کرد یا از طریق فیلترهای شنی فیلتر کرد.
بحث فنی
برای درک بهتر انعقاد و لخته سازی، نظریه ذرات نیاز به توضیح دارد. ما از ذرات به عنوان یک اصطلاح کلی برای همه یون ها یا مولکول های موجود در محلول یا سوسپانسیون استفاده می کنیم.
ذرات موجود در آب تا حدودی بار الکتریکی دارند. نزدیکترین ناحیه به ذره را می توان به دو لایه تقسیم کرد. نزدیکترین یونهای ضد ذرات باردار الکتریکی جمع میشوند و اولین لایه (به نام لایه استرن) را ایجاد میکنند. لایه بعدی از هر دو یون ضد و کویون تشکیل شده است، اما با یون های متضاد مازاد. در نهایت، قسمت عمده ای است که آب اطراف با توزیع یکسانی از یون های متضاد و کویون ها است.
انعقاد فلوکولانت :
این دو لایه در اطراف ذره باعث پایداری آن در آب می شود. هنگامی که شرایط درون آب تغییر می کند، مثلاً با تغییر pH یا رسانایی، مقدار یون های موجود در آب به خوبی تغییر می کند. این تغییر در یون های آب بر میزان یون های دو لایه تأثیر می گذارد و در نتیجه بر پایداری ذرات تأثیر می گذارد. این مکانیسم در انعقاد استفاده می شود.

لخته:
ذرات باردار الکتریکی نیز می توانند با استفاده از پلیمرهای لخته سازی رسوب کنند. پلیمر لخته سازی، پلیمری با محل های باردار است. با استفاده از پلیمر با بار مخالف به عنوان ذراتی که باید لخته شوند، ذرات (ناشی از بارهای مخالف) به پلیمر متصل می شوند و آنها را در ذرات بزرگتر ترکیب می کند، که نمی توانند معلق بمانند.
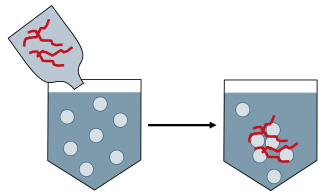
پایان فرایند فلوکولانت:
هنگامی که ذرات یا یونها از محلول رسوب میکنند، برای به دست آوردن کیفیت آب مورد نظر، میتوان عملیات بیشتری را با بهعنوان مثال رسوبگذاری، فیلتر شنی، فیلترهای کیسهای یا حتی فیلتراسیون غشایی (MF/UF) رسوب داد. در نهایت، ذرات رسوبشده را که اکنون به صورت لجن تبدیل میشوند، میتوان با استفاده از فیلتر پرس به لجن بسیار متراکمتر تبدیل کرد تا از یک راهحل کلی جذابتر برای تصفیه فاضلاب اطمینان حاصل شود.
جامدات معلق
معلق جامدات یا جامدات معلق به ذرات جامد کوچکی گفته می شود که آب در آب معلق به صورت کلوئیدی یا به دلیل حرکت می مانند. جامدات معلق را می توان با ته نشینی به دلیل اندازه نسبتا بزرگ آنها حذف کرد. 1 به عنوان شاخص کیفیت آب و قدرت فاضلاب یا فاضلاب به طور کلی استفاده می شود. این یک پارامتر طراحی مهم برای فرآیندهای تصفیه فاضلاب است .
گاهی اوقات به اختصار SS ، اما نباید با جامدات قابل ته نشینی اشتباه گرفته شود ، همچنین به اختصار SS ، که به انسداد لوله فاضلاب کمک می کند.
توضیح
جامدات معلق مهم هستند زیرا آلاینده ها و پاتوژن ها بر روی سطح ذرات حمل می شوند. هرچه اندازه ذرات کوچکتر باشد، کل سطح در واحد جرم ذره بر حسب گرم بیشتر است و بنابراین بار آلاینده احتمالی بیشتر خواهد بود.
حذف
حذف جامدات معلق عموماً از طریق استفاده از رسوبی و/یا فیلترهای آب (معمولاً در سطح شهری) انجام می شود. با حذف بیشتر مواد جامد معلق در یک منبع آب، مقدار قابل توجهی آب به طور کلی به کیفیت شرب نزدیک می شود. این امر با ضدعفونی انجام می شود تا اطمینان حاصل شود که پاتوژن های شناور آزاد یا پاتوژن های مرتبط با مقدار کمی از جامدات معلق باقی مانده بی اثر می شوند.
اثربخشی فیلتر
استفاده از یک فیلتر پارچه ای بسیار ساده ، متشکل از یک ساری را که در آب حمل می شود به شدت کاهش می دهد پنبه ای تا شده، بار وبا و برای افراد بسیار فقیر مناسب است. در این صورت می توان یک روش ضد عفونی با تکنولوژی مناسب مانند ضدعفونی آب خورشیدی اضافه کرد .
یک استثنای مهم برای این تعمیم، آلودگی آب های زیرزمینی با آرسنیک است ، زیرا آرسنیک یک آلاینده بسیار جدی است که محلول است و در نتیجه با حذف مواد جامد معلق حذف نمی شود. این امر حذف آن را بسیار دشوار می کند و یافتن منبع آب جایگزین اغلب واقعی ترین گزینه است.
کلوئید
در فیزیک و شیمی ، یک سیستم کلوئیدی ، سیستم کلوئیدی ، تعلیق کلوئیدی یا پراکندگی کلوئیدی ، سیستمی است که از دو یا چند فاز تشکیل شده است که معمولاً یکی سیال (مایع یا گاز) و دیگری به شکل ذرات بسیار ریز جامد پراکنده شده است . قطر بین 10-9 و 10-5 متر. 1 فاز پراکنده فازی است که با کمترین نسبت یافت می شود. به طور معمول فاز پیوسته مایع است ، اما کلوئیدهایی را می توان یافت که اجزای آنها در حالت های دیگر تجمع ماده هستند .
نام کلوئید از ریشه یونانی “kolas” به معنای “که می تواند به هم بچسبد” گرفته شده است. این نام به یکی از ویژگی های اصلی کلوئیدها اشاره دارد: تمایل خود به خود آنها به تجمع یا تشکیل لخته . همچنین کلمه “چسب” از اینجا آمده است، مایع خمیری که برای چسب استفاده می شود. کلوئیدها همچنین بر نقطه جوش آب تأثیر می گذارند و هستند آلاینده . متفاوت هستند با سوسپانسیون های شیمیایی کلوئیدها عمدتاً در اندازه ذرات فاز پراکنده . ذرات موجود در کلوئیدها مستقیماً قابل مشاهده نیستند، آنها در سطح میکروسکوپی (بین 1 نانومتر تا 1 میکرومتر ) و در سوسپانسیون های شیمیایی در سطح ماکروسکوپی (بیشتر از 1 میکرومتر) قابل مشاهده هستند. همچنین، در حالت ایستاده، فازهای یک سوسپانسیون شیمیایی از هم جدا می شوند، در حالی که فازهای یک کلوئید از هم جدا نمی شوند. سوسپانسیون شیمیایی قابل فیلتر است ، در حالی که کلوئید قابل فیلتر نیست.
سیستم های کلوئیدی سیستم های غیر همگنی هستند که در آنها ذرات تشکیل دهنده یک یا چند جزء آن (فاز پراکنده یا پراکنده) دارای اندازه های بین 10 تا 2000 Å هستند، در حالی که اجزای باقی مانده از ذرات با اندازه کمتر از حدود 10 تشکیل شده اند. Å (فاز پراکنده یا محیط پراکنده). 2
ذرات کلوئیدی دارای خواص واسطه ای بین محلول های شیمیایی و سوسپانسیون ها هستند. آنها بدون اینکه به مولکول های حلال متصل شوند پراکنده می شوند و در حالت ایستاده ته نشین نمی شوند. 3
در برخی موارد ذرات مولکولهای بزرگی مانند پروتئین هستند . در فاز آبی، یک مولکول به گونهای تا میشود که قسمت آبدوست آن در خارج قرار میگیرد، یعنی بخشی که میتواند با مولکولهای آب از طریق نیروهای یون-دوقطبی یا نیروهای پیوند هیدروژنی برهمکنش ایجاد کند، به سمت چپ حرکت میکند. مولکول کلوئیدها می توانند ویسکوزیته خاصی داشته باشند (ویسکوزیته مقاومت داخلی است که یک سیال نشان می دهد: مایع یا گاز ، به حرکت نسبی مولکول های آن).
انواع کلوئیدها
کلوئیدها بر اساس میزان جاذبه بین فاز پراکنده و فاز پیوسته یا پراکنده طبقه بندی می شوند. اگر دومی مایع باشد، سیستمهای کلوئیدی بهعنوان «سل» طبقهبندی میشوند و به « لیوفوبیک» (جاذبه کم بین فاز پراکنده و محیط پراکنده) و «لیوفیلیک» (جاذب زیاد بین فاز پراکنده و محیط پراکنده) تقسیم میشوند. در کلوئیدهای لیوفیل، فاز پراکنده و محیط پراکنده به هم مرتبط هستند، بنابراین محلول های واقعی را تشکیل می دهند و از نظر ترمودینامیکی پایدار هستند. در حالی که کلوئیدهای لیوفوبیک آنهایی هستند که فاز پراکنده و محیط پراکنده ارتباطی ندارند، می توانند دو فاز تشکیل دهند و از نظر جنبشی پایدار هستند. یک ویژگی اساسی کلوئیدهای لیوفوبیک این است که از نظر ترمودینامیکی پایدار نیستند، همانطور که در بالا ذکر شد، اگرچه دارای ثبات جنبشی هستند که به آنها اجازه می دهد برای مدت طولانی در حالت پراکنده باقی بمانند. ذرات کلوئیدی به اندازه کافی کوچک هستند که رفتار آنها توسط حرکت براونی کنترل می شود و نه توسط اثرات ماکروسکوپی، مانند نیروهای گرانشی. با افزودن مقدار معینی الکترولیت می توانند منعقد شوند، مقدار آن به ظرفیت و ماهیت الکترولیت بستگی دارد. در مورد طبقه بندی کلوئیدها نیز باید توجه داشت که اگر محیط پراکنده آب باشد، آنها را «آب گریز» (دفع آب) و «آب دوست» (جذب به آب) می نامند.
جدول زیر انواع مختلف کلوئیدها را با توجه به وضعیت فازهای پیوسته و پراکنده آنها فهرست می کند: 4
| فاز پراکنده | ||||
|---|---|---|---|---|
| گاز | مایع | جامد | ||
| فاز پیوسته | گاز | این امکان پذیر نیست زیرا همه گازها محلول در یکدیگر هستند. | اسپری مایع ، مثال: مه ، مه | اسپری جامد، مثال: دود ، گرد و غبار در حالت تعلیق |
| مایع | فوم ، مثال: فوم اصلاح، کرم | امولسیون ، مثال: شیر ، سس مایونز ، کرم های آرایشی | سول ، مثالها: نقاشیها ، جوهر هند | |
| جامد | فوم جامد ، مثال: پوکه ، آئروژل ، مرنگ. | ژل ، مثال: ژله ، ژله لوبیا ، پنیر | خورشید جامد ، مثال: کریستال یاقوت | |
در اصل، هیچ قانون ثابتی وجود ندارد که وضعیت تجمع را که در آن فاز پراکنده و محیط پراکنده باید پیدا شود، ایجاد کند. بنابراین، تمام ترکیبات قابل تصور، همانطور که در جدول بالا نشان داده شده است، امکان پذیر است.
در حال حاضر و به دلیل کاربردهای صنعتی و زیست پزشکی آن، مطالعه کلوئیدها در شیمی فیزیک و فیزیک کاربردی اهمیت زیادی پیدا کرده است . بنابراین، گروه های تحقیقاتی متعددی در سراسر جهان به مطالعه خواص نوری ، صوتی و پایداری و رفتار آنها در مواجهه با میدان های خارجی اختصاص یافته اند. به ویژه، رفتار الکتروکینتیک (عمدتاً اندازهگیریهای تحرک الکتروفورتیک ) یا هدایت الکتریکی کل سیستم تعلیق.
به طور کلی، مطالعه کلوئیدها تجربی است، اگرچه تلاش های زیادی در مطالعات نظری و همچنین در توسعه شبیه سازی کامپیوتری رفتار آنها انجام می شود. در بیشتر پدیدههای کلوئیدی، مانند رسانایی و تحرک الکتروفورتیک ، این نظریهها فقط واقعیت را به صورت کیفی بازتولید میکنند، اما توافق کمی هنوز کاملاً رضایتبخش نیست.
آماده سازی
دو راه اصلی برای تهیه کلوئید وجود دارد: 5
- پراکندگی ذرات یا قطرات بزرگ به ابعاد کلوئیدی با آسیاب کردن، پودر کردن یا اعمال برشی (مثلاً هم زدن، اختلاط یا اختلاط با تنش برشی بالا).
- تراکم مولکول های کوچک محلول به ذرات کلوئیدی بزرگتر توسط واکنش های رسوب، تراکم یا ردوکس. از این فرآیندها در تهیه سیلیس کلوئیدی یا طلای کلوئیدی استفاده می شود.
تثبیت
پایداری یک سیستم کلوئیدی توسط ذرات معلق در محلول تعریف می شود و به نیروهای برهمکنش بین ذرات بستگی دارد. اینها شامل فعل و انفعالات الکترواستاتیک و نیروهای واندروالس است، زیرا هر دو به انرژی آزاد کلی سیستم کمک می کنند. 6
یک کلوئید پایدار است اگر انرژی برهمکنش ناشی از نیروهای جاذبه بین ذرات کلوئیدی کمتر از kT باشد که k ثابت بولتزمن و T دمای مطلق است. در این صورت، ذرات کلوئیدی یکدیگر را دفع میکنند یا به صورت ضعیفی جذب میشوند و ماده در حالت تعلیق باقی میماند.
اگر انرژی برهمکنش بیشتر از kT باشد، نیروهای جاذبه غالب خواهند شد و ذرات کلوئیدی شروع به جمع شدن با هم خواهند کرد. این فرآیند عموماً تجمع نامیده می شود، اما به آن لخته سازی ، انعقاد یا رسوب نیز می گویند. 7 در حالی که این اصطلاحات اغلب به جای یکدیگر استفاده می شوند، برای برخی از تعاریف معانی کمی متفاوت دارند. به عنوان مثال، انعقاد را می توان برای توصیف تجمع دائمی برگشت ناپذیر استفاده کرد که در آن نیروهای نگهدارنده ذرات در کنار هم قوی تر از هر نیروی خارجی ناشی از هم زدن یا اختلاط هستند. لخته سازی را می توان برای توصیف تجمع برگشت پذیر شامل نیروهای جاذبه ضعیف تر مورد استفاده قرار داد و معمولاً به آن سنگدانه unfloc می گویند. اصطلاح رسوب معمولاً برای توصیف تغییر فاز از یک پراکندگی کلوئیدی به یک جامد (رسوب) زمانی که در معرض اختلال قرار میگیرد، استفاده میشود. 8 تجمع باعث رسوب یا کرم شدن می شود، بنابراین کلوئید ناپایدار است: اگر هر یک از این فرآیندها رخ دهد، کلوئید دیگر یک سوسپانسیون نخواهد بود.

نمونه هایی از پراکندگی کلوئیدی پایدار و ناپایدار.
تثبیت الکترواستاتیک و تثبیت فضایی دو مکانیسم اصلی تثبیت در برابر تجمع هستند.
- تثبیت الکترواستاتیکی مبتنی بر دفع متقابل بارهای الکتریکی مشابه است. بار ذرات کلوئیدی در یک لایه الکتریکی دوتایی ساخته شده است، جایی که ذرات در سطح باردار می شوند، اما سپس یون های متضاد (یون هایی با بار مخالف) که ذره را احاطه کرده اند، جذب می کنند. دافعه الکترواستاتیکی بین ذرات کلوئیدی معلق به راحتی بر حسب پتانسیل زتا تعیین می شود. اثر ترکیبی جاذبه واندروالس و دافعه الکترواستاتیکی بر تجمع به صورت کمی توسط نظریه DLVO توصیف شده است . 8 یک روش متداول برای تثبیت یک کلوئید (تبدیل آن به رسوب)، پپتیزاسیون است، فرآیندی که در آن با یک الکترولیت هم زده میشود.
- تثبیت فضایی شامل جذب لایه ای از پلیمر یا سورفکتانت بر روی ذرات برای جلوگیری از نزدیک شدن آنها به محدوده نیروهای جاذبه است. 8 پلیمر شامل زنجیرهایی است که به سطح ذره متصل می شوند و بخشی از زنجیره که به سمت بیرون امتداد می یابد در محیط معلق محلول است. 9 این تکنیک برای تثبیت ذرات کلوئیدی در انواع حلال ها از جمله حلال های آلی استفاده می شود. 10
ترکیبی از این دو مکانیسم (تثبیت الکترواستریک) نیز امکان پذیر است.

روشی به نام تثبیت شبکه ژل، راه اصلی برای تولید کلوئیدهایی است که در برابر تجمع و رسوب پایدار هستند. به سوسپانسیون کلوئیدی این روش شامل افزودن پلیمری است که قادر به تشکیل یک شبکه ژل است. نشست ذرات به دلیل صلبیت ماتریس پلیمری که در آن ذرات به دام میافتند، مختل میشود، 11 و زنجیرههای پلیمری طولانی میتوانند تثبیت فضایی یا الکترواستریک را برای ذرات پراکنده فراهم کنند. نمونه هایی از این مواد زانتان و صمغ گوار هستند.
بی ثباتی
بی ثباتی را می توان با روش های مختلفی به دست آورد:
- حذف سد الکترواستاتیکی که مانع از تجمع ذرات می شود. این را می توان با افزودن نمک به یک سوسپانسیون برای کاهش طول الک Debye (عرض لایه دوتایی الکتریکی) ذرات انجام داد. همچنین با تغییر pH یک سوسپانسیون برای خنثی کردن موثر بار سطحی ذرات معلق به دست می آید. این نیروهای دافعه ای را که ذرات کلوئیدی را از هم دور نگه می دارند حذف می کند و به دلیل نیروهای واندروالس امکان تجمع را فراهم می کند. تغییرات جزئی در pH می تواند در تغییر قابل توجهی در پتانسیل زتا ظاهر شود. هنگامی که بزرگی پتانسیل زتا زیر یک آستانه مشخص است، معمولاً در حدود ± 5 میلی ولت، لخته شدن یا تجمع سریع رخ می دهد. 12
- افزودن فلوکولانت پلیمری باردار. لخته سازهای پلیمری می توانند ذرات کلوئیدی منفرد را از طریق برهمکنش های الکترواستاتیکی جذاب به یکدیگر متصل کنند. به عنوان مثال، ذرات سیلیس کلوئیدی یا خاک رس با بار منفی می توانند با افزودن یک پلیمر با بار مثبت لخته شوند.
- افزودن پلیمرهای غیرجذب به نام Depletants که به دلیل اثرات آنتروپیک باعث تجمع می شوند.
سوسپانسیونهای کلوئیدی ناپایدار با کسر حجم کم، سوسپانسیونهای مایع جمعشده را تشکیل میدهند، که در آن تودههای منفرد ذرات در صورت چگالی بیشتر از محیط معلق، یا کرم اگر چگالی کمتری دارند، رسوب میکنند. با این حال، سوسپانسیون های کلوئیدی کسر حجمی بیشتر، ژل های کلوئیدی با خواص ویسکوالاستیک را تشکیل می دهند. ژل های کلوئیدی ویسکوالاستیک، مانند بنتونیت و خمیر دندان، مانند مایعات در زیر برش جریان دارند، اما با برداشتن برش، شکل خود را حفظ می کنند. به همین دلیل است که خمیردندان را می توان از لوله خمیر دندان خارج کرد، اما پس از استفاده روی مسواک باقی می ماند.
پایش پایداری

پرکاربردترین تکنیک برای نظارت بر وضعیت پراکندگی یک محصول و شناسایی و تعیین کمیت پدیدههای بیثباتی، پراکندگی نور چندگانه در ارتباط با اسکن عمودی است. 13 14 15 16 این روش که به نام کدورت سنجی شناخته می شود، مبتنی بر اندازه گیری کسر نور است که پس از ارسال از طریق نمونه، توسط ذرات کلوئیدی به عقب پراکنده می شود. شدت پراکندگی برگشتی با میانگین اندازه ذرات و کسر حجمی فاز پراکنده رابطه مستقیم دارد. بنابراین، تغییرات موضعی در غلظت ناشی از ته نشینی یا خامه شدن، و تجمع ذرات ناشی از تجمع شناسایی و نظارت می شود. 17 این پدیده ها با کلوئیدهای ناپایدار مرتبط هستند.
پراکندگی دینامیک نور می تواند برای تشخیص اندازه یک ذره کلوئیدی با اندازه گیری سرعت انتشار آنها استفاده شود. این روش شامل هدایت نور لیزر به یک کلوئید است. نور پراکنده یک الگوی تداخلی را تشکیل می دهد و نوسان شدت نور در این الگو ناشی از حرکت براونی ذرات است. اگر اندازه ظاهری ذرات به دلیل انباشته شدن آنها در کنار هم افزایش یابد، حرکت براونی کندتر رخ خواهد داد. اگر اندازه ذرات ظاهری فراتر از محدوده اندازه معمولی ذرات کلوئیدی باشد، این روش میتواند تأیید کند که تجمع رخ داده است. 6
تسریع روشهای پیشبینی عمر مفید
فرآیند جنبشی بیثباتی میتواند بسیار طولانی باشد (تا چندین ماه یا حتی سالها برای برخی محصولات) و اغلب لازم است فرمولساز از روشهای شتاب اضافی برای دستیابی به زمان توسعه معقول برای طراحی محصول جدید استفاده کند. روش های حرارتی بیشترین استفاده را دارند و شامل افزایش دما برای تسریع بی ثباتی (زیر دماهای بحرانی برای وارونگی فاز یا تخریب شیمیایی) می شوند. دما نه تنها بر ویسکوزیته، بلکه بر کشش سطحی در مورد سورفکتانت های غیریونی یا به طور کلی بر نیروهای برهمکنش درون سیستم تأثیر می گذارد. ذخیره سازی پراکندگی در دمای بالا، شبیه سازی شرایط واقعی یک محصول (به عنوان مثال، یک لوله کرم ضد آفتاب در خودرو در تابستان) و همچنین سرعت بخشیدن به فرآیندهای بی ثباتی تا 200 برابر امکان پذیر است. گاهی اوقات سانتریفیوژ انجام می شود. استفاده شده و آشفتگی آنها محصول را در معرض نیروهای مختلفی قرار می دهند که ذرات / قطرات را به یکدیگر فشار می دهد و در نتیجه به زهکشی فیلم کمک می کند. با این حال، برخی از امولسیون ها هرگز در گرانش معمولی با هم ترکیب نمی شوند، در حالی که در گرانش مصنوعی این کار را انجام می دهند. 18 علاوه بر این، جداسازی جمعیتهای ذرات مختلف هنگام استفاده از سانتریفیوژ و ارتعاش برجسته شده است. 19
سیستم های کلوئیدی
- امولسیون : امولسیون به سوسپانسیون کلوئیدی یک مایع در مایع دیگر که با آن غیر قابل اختلاط است گفته می شود و می توان آن را با هم زدن مخلوطی از دو مایع یا با عبور نمونه از آسیاب کلوئیدی به نام هموژنایزر تهیه کرد. امولسیون سیستمی است که در آن فاز پراکنده و فاز پیوسته مایع هستند.
- Sols: sols لیوفوبیک نسبتا ناپایدار (یا متاپایدار) هستند. اغلب مقدار کمی الکترولیت یا افزایش دما برای ایجاد انعقاد و رسوب ذرات پراکنده کافی است.
- آئروسل ها: آئروسل ها به عنوان سیستم های کلوئیدی با ذرات جامد یا مایع بسیار ریز تقسیم شده، پراکنده در یک گاز تعریف می شوند. امروزه اصطلاح آئروسل، به طور کلی، مترادف با ظرف فلزی با محتوای تحت فشار است، اگرچه ما از آئروسل های جوی صحبت می کنیم.
- ژل : تشکیل ژل را ژل شدن می نامند. به طور کلی، انتقال از سل به ژل یک فرآیند تدریجی است. البته ژل شدن با افزایش ویسکوزیته همراه است که ناگهانی نیست بلکه تدریجی است.
- فوم : فاز پراکنده می تواند مایع یا جامد و فاز پراکنده گاز باشد.
خواص کلوئیدها
جذب
ذرات کلوئیدی به دلیل اندازه، نسبت مساحت به جرم بسیار زیادی دارند، به همین دلیل است که مواد جاذب عالی هستند. بر روی سطح ذرات نیروهایی به نام واندروالس و حتی پیوندهای بین اتمی وجود دارد که در صورت عدم رضایت، می توانند اتم ها، یون ها یا مولکول های مواد خارجی را جذب و حفظ کنند. به این چسبیدن مواد خارجی به سطح ذره، جذب می گویند. مواد جذب شده در لایه هایی که معمولاً بیش از یک یا دو مولکول (یا یون) ضخامت ندارند، به طور محکم در کنار هم نگه داشته می شوند. اگرچه جذب یک پدیده عمومی در جامدات است، اما به دلیل مساحت بسیار زیاد سطح، به ویژه در پراکندگی های کلوئیدی کارآمد است.
اثر تیندال
این شامل یک پرتو نور است که هنگام عبور از یک سیستم کلوئیدی قابل مشاهده است. این پدیده به این دلیل است که ذرات کلوئیدی نور را در همه جهات پراکنده می کنند و آن را قابل مشاهده می کنند. پرتوهای نور را می توان در حال عبور از جنگل مشاهده کرد، به عنوان مثال، در نتیجه پراکندگی نور توسط ذرات کلوئیدی معلق در هوای جنگل. اگرچه همه گازها و مایعات نور را پراکنده می کنند، اما پراکندگی توسط یک ماده خالص یا یک محلول بسیار کم است که معمولاً قابل تشخیص نیست.
جنبش
براونی
نمونه هایی از این پدیده، حرکات مشاهده شده در ذرات گرد و غبار است که به طور تصادفی در یک پرتو نور خورشید که از پنجره وارد می شود (یا یک پرده باز)، یا ذرات غبار و دود در حال حرکت در پرتو نوری است که از اتاق پروجکشن یک فیلم می آید. تئاتر حرکت نامنظم ذرات کلوئیدی مذکور به دلیل بمباران یا برخورد با مولکولهای محیط پراکنده است و در مثالهای ذکر شده توسط مولکولهای موجود در هوا (N²، O²، Ar، Kr، و غیره) است. این حرکت به یاد رابرت براون گیاه شناس انگلیسی، که اولین بار در سال 1827، در حالی که رفتار دانه های گرده معلق در آب را زیر میکروسکوپ مطالعه می کرد، این حرکت نامنظم ذرات را مشاهده کرد، به جنبش براونی معروف است. حرکت براونی از ته نشین شدن ذرات کلوئیدی یا تشکیل رسوبات هوا جلوگیری می کند .
- الکتروفورز
این شامل مهاجرت ذرات باردار کلوئیدی در یک میدان الکتریکی است. ذرات کلوئیدی یون های سطح خود را جذب می کنند و خود را به صورت مثبت یا منفی شارژ می کنند، اگرچه کل سیستم کلوئیدی از نظر الکتریکی خنثی است، اما این ذرات از طریق نیروهای الکتریکی جذاب به سمت الکترودها (کاتد و آند) می روند.
دیالیز
این به عنوان حرکت یون ها و مولکول های کوچک از طریق یک غشای متخلخل، به نام غشای دیالیز یا دیالیز تعریف می شود، اما نه مولکول های بزرگ یا ذرات کلوئیدی. دیالیز یک ویژگی انحصاری کلوئیدها نیست، زیرا محلول های خاصی را نیز می توان دیالیز کرد، به عنوان مثال، در بیوشیمی دیالیز اغلب برای جدا کردن مولکول های پروتئین از یون های آبی استفاده می شود. در کلوئیدها، دیالیز امکان تصفیه سیستم کلوئیدی را فراهم می کند، زیرا یون ها و سایر مولکول های کوچک ناخالصی از بین می روند. سلفون و غشاهای با منشاء حیوانی به عنوان غشای دیالیز استفاده می شود.
برهمکنش دوقطبی-دوقطبی
جاذبه برهمکنش دوقطبی-دوقطبی شامل الکترواستاتیکی بین انتهای مثبت یک مولکول قطبی و انتهای منفی یک مولکول دیگر است. نوع پیوند هیدروژنی خاصی از برهمکنش دوقطبی-دوقطبی است.
برهمکنش بین دوقطبی های الکتریکی مولکول های کلرید هیدروژن .
نیروهای الکترو استاتیک بین دو یون با ضریب 1/ d 2 کاهش می یابد که جدایی آنها d افزایش می یابد . از سوی دیگر، نیروهای دوقطبی با توجه به 1/ d 3 ( d سوم افزایش یافته به توان ) متفاوت است و فقط در فواصل بسیار کوتاه موثر هستند. آنها همچنین نیروهای ضعیف تری نسبت به حالت یون-یون هستند زیرا q+ و q- نشان دهنده بارهای جزئی هستند. میانگین انرژی های برهمکنش های دوقطبی تقریباً 4 کیلوژول بر مول است، برخلاف مقادیر متوسط انرژی های پیوند یونی و کووالانسی مشخصه (~400 کیلوژول در مول).
اینها کمی جهت دار هستند، یعنی با افزایش دما ، حرکت انتقالی، چرخشی و ارتعاشی مولکول ها افزایش می یابد و جهت گیری تصادفی تری بین آنها ایجاد می کند. در نتیجه، قدرت برهمکنش های دوقطبی-دوقطبی با افزایش دما کاهش می یابد.
انواع پیوند دوقطبی-دوقطبی
دائمی پیوندهای دوقطبی بین مولکول هایی که دارای گشتاور دوقطبی ذاتی هستند، رخ می دهد. این معمولاً می تواند مربوط به تفاوت در الکترونگاتیوی باشد. از طرف دیگر اتمها و مولکولهای غیرقطبی، که گشتاور دوقطبی دائمی ندارند، قطبیپذیر هستند ، یعنی میتوانند در واکنش به میدان الکتریکی مجاور ، دوقطبیهای الکتریکی تشکیل دهند. پیوند بین یک اتم یا مولکول غیرقطبی و یک مولکول دوقطبی، دوقطبی القای دوقطبی دائمی نامیده میشود و از نظر برد حتی کوتاهتر است.